CancerQuest presenta: Tratamiento del Cáncer: Quimioterapia. Dé click en la imagen para ver un documental.

El término 'quimioterapia', o 'quimio', se refiere a una gran variedad de fármacos empleados en el tratamiento del cáncer. Estos medicamentos normalmente funcionan al matar las células en división. Ya que las células cancerígenas no poseen muchas de las funciones regulatorias presentes en las células normales, estas continúan dividiéndose cuando las otras células ya no lo hacen. Esta característica hace que las células cancerígenas sean susceptibles a una gran variedad de venenos celulares.
La función de estos agentes quimioterapeúticos consta en causar la muerte celular en una variedad de maneras. Algunos de estos medicamentos son compuestos naturales que se encuentran en varios tipos de plantas, y algunos son químicos artificiales. A seguir, se encuentra un listado de algunos tipos de fármacos quimioterapeúticos con descripciones correspondientes. Para más información sobre cierto tipo de medicamento, escoja de la lista debajo.
- Antimetabolitos: Fármacos que interfieren con la formación de biomoléculas claves dentro de las células, incluyendo los nucleótidos, componentes básicos del ADN. Estos medicamentos interfieren con la replicación del ADN y por lo tanto con la división celular.
- Antagonistas de Folatos: inhiben la actividad de la dihidrofolato reductasa (DHFR), una enzima involucrada en la formación de nucleótidos. También se los conoce como antifolatos.
- Antagonistas de Purina: químicos necesarios para la formación de los nucleótidos del ADN y del ARN
- Antagonistas de Pirimidina: bloquean la síntesis de los nucleótidos que contienen pirimidinas
- Agentes genotóxicos: Fármacos dañinos al ADN. Al causar daños en el ADN, estos agentes interfieren con la replicación del ADN y la división celular.1
- Inhibidores del huso mitótico: Estos agentes ocasionan defectos dentro de la división celular al interferir con los componentes citoesqueletales que provocan que la célula se divida en dos1
- Otros agentes quimioterapeúticos: Estos agentes inhiben la división celular mediante mecanismos distintos a los que se encuentran en este listado.
- Glosario de términos quimioterapéuticos: Descripciones de fármacos quimioterapéuticos inclusivos de sus nombres comerciales, nombres genéricos, y tipos, con enlaces a más información.
Las células normales son más resistentes a los medicamentos, pues estas detienen su división cuando las condiciones ya no son favorables. Sin embargo, estos fármacos también afectan a algunas células normales, lo cual produce la toxicidad de estas drogas. Las células que normalmente se encuentran en replicación rápida (aquellas ubicadas en la médula ósea y en la pared del intestino por ejemplo), tienden a ser las más afectadas. La muerte de las células normales provoca la ocurrencia de los efectos secundarios más comunes en la quimioterapia.

Mire el video para saber como el sobreviviente de sarcoma Ned Crystal manejó los efectos secundarios de una alta dosis de quimioterapia. Mire la entrevista completa con Ned Crystal.
Antimetabolitos
Para poder aprender acerca de los antimetabolitos y sus mecanismos de función, es necesario conocer los procesos en los que estos agentes están involucrados. El término 'metabolismo' se refiere a las reacciones químicas que ocurren en nuestros cuerpos. Por ejemplo, nuestros cuerpos convierten a los alimentos que ingerimos en componentes útiles para producir proteínas, ADN y otras estructuras celulares. 'Metabolito' es un término general para categorizar a los compuestos orgánicos que se sintetizan, reciclan, o se desechan en las células. Los materiales que nos proveen con metabolitos claves entran a nuestros cuerpos a través de la alimentación. Estos alimentos deben digerirse y convertirse en estructuras más simples para poder reusarlos nuestras células. Ejemplos de éstos incluyen las vitaminas y los aminoácidos. Algunos metabolitos son productos finales de un proceso metabólico, y se los excreta fuera del cuerpo. Por ejemplo, la urea, el producto final del metabolismo de proteínas, se desecha a través de la orina.
Los Antimetabolitos comparten estructuras similares con los metabolitos, sin embargo, el cuerpo no los puede utilizar productivamente. Consecuentemente, la célula se confunde entre los antimetabolitos y metabolitos, y por ende, ambos tipos de moléculas se procesan indiscriminadamente dentro de las células. De este modo, la presencia de los antimetabolitos previene la realización de las funciones vitales de las células, impidiendo el crecimiento y la supervivencia de las mismas. Varios antimetabolitos empleados en el tratamiento del cáncer interfieren con la producción de los ácidos nucleicos, ARN y ADN.2 Si la célula no logra producir más moléculas de ADN, las célula no podrá dividirse.
A seguir se encuentra un listado de las clases más comunes de antimetabolitos:
¿Cómo funcionan los antimetabolitos?
La respuesta a esta pregunta se explica con la interacción de los antimetabolitos con la timidilato sintasa, Por ejemplo, el 5-fluorouracilo (abreviado como 5-FU), un antimetabolito, inhibe la síntesis normal del ADN al prevenir la síntesis de la timina a partir de nucleótidos de uracilo. La timina se distingue del uracilo ya que contiene un grupo metil (unidad de un carbono) en el quinto carbono del anillo de pirimidina. Una enzima denominada timidilato sintasa, añade este grupo metil. Si una molécula de 5-FU se encuentra en el nucleótido en vez del uracilo, la enzima no logra añadir el grupo metil al quinto carbono. Esta alteración de la pirimidina normal le da el nombre al fármaco. La adición del metil es necesaria poder convertir un nucleótido de uracilo a un nucleótido de timina. Sin este paso, los nucleótidos no se producen y por consiguiente no se encuentran disponibles para la síntesis del ADN.
A seguir se encuentra una ilustración del proceso normal (la parte superior del diagrama) y la inhibición del proceso por 5-FU (la parte inferior del diagrama).
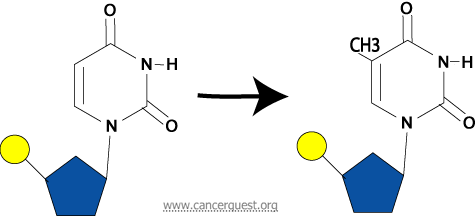

Antagonistas de Folato
Los antagonistas de folato, también conocidos como antifolatos, inhiben la dihidrofolato reductasa (DHFR), una enzima involucrada en la formación de nucleótidos. Cuando esta enzima está bloqueada, los nucleótidos no pueden ser formados, interrumpiendo la replicación del ADN y la división celular. El metotrexato es el antagonista de folato primordial usado como un agente quimioterapeútico, y se lo puede administrar por sí solo, o en conjunto con otros fármacos anticancerosos.
Descubrimiento del Agente
En el 1948, se halló que una dieta con niveles reducidos de ácido fólico producía una disminución del conteo de las células leucémicas. Este descubrimiento empezó la búsqueda de los antagonistas de folato. El mismo año, un antifolato, aminopterina, demostró producir remisiones en las leucemias infantiles. El metotrexato fue descubierto un poco después, y fue comprobado como un análogo más eficaz y menos tóxico. Desde entonces, a pesar del aislamiento de otros antagonistas de folato, metotrexato mantiene un importante rol como un tratamiento para el cáncer de seno, sarcoma osteogénico, y las leucemias. 3
Metotrexato
Pemetrexed (Alimta®)
¿Cómo funcionan los antagonistas de folato?
El mecanismo de función de los antifolatos de metotrexato modela la función general de los antifolatos:
El ácido fólico es un factor de crecimiento que provee carbonos individuales a los precursores usados en la formación de nucleótidos durante la síntesis de ADN y ARN. Los antifolatos, bloquean el sitio activo de la dehidrofolato reductasa (DHFR), una enzima que transforma al ácido fólico a su forma activa. A esta forma activa se la denomina folato, una coenzima esencial para la metilación (agregación de un grupo metilo, unidades de un átomo de carbono). Por ende, la inhibición de la dihidrofolato reductasa mantiene al ácido fólico en su estado inactivo. Se presume que una disminución en la cantidad de folatos activos provoca una disminución en la metilación, inhibiendo un paso necesario en la formación de purinas y timidilatos. Cuando es afectada la formación de ácidos nucléicos debido a la falta de nucleótidos, el crecimiento celular se interrumpe.4 El metotrexato es el antagonista de folato más usado.
Más detalles:
El ácido fólico, la estructura base de todos los folatos, no se considera útil hasta que se reduce químicamente. La enzima que reduce el ácido fólico es la dihidrofolato reductasa (DHFR). Primeramente, la DHFR reduce al ácido fólico para producir un dihidrofolato. Seguidamente, la DHFR reduce al dihidrofolato, formando un tetrahidrofolato (folato activo), un compuesto que sirve como un 'donador' de grupos metil. Los grupos metil se unen al N-5 y/o al N-10 del tetrahidrofolato que transporta a estos grupos metil hacia otros compuestos. La enzima timidilato sintasa (TS) cataliza la transferencia del carbono del tetrahidrofolato a las moléculas deseadas. Para poder hacer esto, la TS debe oxidar el anillo de folato del tetrahidrofolato, reviertiéndolo a un dihidrofolato. Para que se repita este proceso, las células deben emplear un uso repetido de la DHFR para reducir el dihidrofolato en su forma activa, el tetrahidrofolato. Esto requiere una actividad continua de DHFR.
El metotrexato inhibe la actividad de la DHFR al formar una unión con la enzima, estrecha pero reversiblemente, desactivándola. El metotrexato entra a célula a través de receptores específicos a los folato, transportadores de folatos de pH bajo, o unidos a portadores de folatos reducidos. Una vez dentro de la célula, el metotrexato se une a la DHFR. Esta unión reduce la cantidad de DHFR disponible en la célula, y detiene la reducción de los precursores del tetrahidrofolato, como el ácido fólico y el ácido hidrofólico. Sin el tetrahidrofolato, el folato activo, la célula no puede crear nuevos nucleótidos de purinas y timidinas para la síntesis del ADN. Sin la replicación, el crecimiento se bloquea.4
Antagonistas de Purina
Las purinas (la adenina y la guanina) son químicos que se emplean en la producción de nucleótidos del ADN y del ARN. La otra clases de bases, las pirimidinas, cuenta con la timina y a la citosina en el ADN, y con la citosina y el uracilo en el ARN.
Antes de que una célula pueda dividirse, debe duplicar su contenido de ADN, para que cada célula hija tenga una combinación idéntica y completa de la información genética. Este proceso de duplicación (denominado replicación) se compara con una línea de ensamblaje, en la cual los nucleótidos se unen entre sí para formar una molécula de ADN nueva. Los grupos de fosfato y las moléculas de azúcares se unen para crear largas cadenas de ADN. La incorporación de un antagonista de purina previene el crecimiento continuo del ADN y previene la división celular.5
Los antagonistas de purinas funcionan al inhibir la síntesis del ADN de dos maneras diferentes:
-
Estos pueden inhibir la producción de la adenina o de la guanina, componentes importantes de los nucleótidos. Si una célula no consta suficientes purinas, el síntesis del ADN se detiene y la célula no logra dividirse.5
-
Se pueden incorporar dentro de la molécula del ADN durante la síntesis del mismo. Se presume que la presencia del inhibidor interfiere con la división celular.5
El antimetabolito de purina más conocido es el aciclovir, un agente antiviral usado en el tratamiento de infecciones por herpesvirus. Actualmente, los antagonistas de purinas también se emplean al tratar a pacientes con cáncer, incluyendo a la 6-mercaptopurina (6-MP) y 6-tioguanina (6-TG). Estos fármacos son parecidos entre sí, y funcionan de la misma manera. Las estructuras de las purinas normales (adenina y guanina) con sus antagonistas (6-MP y 6-TG) se ilustran en los siguientes diagramas:

Con el tiempo, varios tipos de cánceres se han vuelto menos sensibles, o más resistentes, a los agentes que se usan para tratarlos. Aprenda sobre la resistencia a las drogas contra el cáncer.
Algunos ejemplos antagonistas de purinas son:
Antagonistas de Pirimidinas
Los antagonistas de pirimidinas actúan al bloquear la síntesis de los nucleótidos que contienen pirimidinas (la citiosina y la tirosina en el ADN; la citosina y el uracilo en el ARN). Los fármacos que bloquean la construcción de estos nucleótidos tienen estructuras parecidas al compuesto natural. Al actuar como "señuelos", estos químicos pueden prevenir la producción de los nucleótidos. Estos antagonistas pueden ejercer sus efectos en distintas etapas de este proceso de producción, y por ende, pueden inhibir directamente a varias enzimas cruciales. Los antagonistas de pirimidinas también se pueden incorporar dentro de la cadena creciente del ADN y provocar la suspensión del proceso.
Para que una célula pueda reproducirse, primero debe replicar todo el ADN de su genoma con exactitud. Durante la síntesis del ADN, las moléculas de pirimidinas y purinas deben estar disponibles, pues son los componentes básicos de los nucleótidos, y así poder llegar a la meta final, la producción de nuevas moléculas de ADN. Una reducción en la disponibilidad de las materias primas para construir ADN ocasionada por los antagonistas de pirimidinas, resulta en la detención de la síntesis del ADN y la inhibición de la división celular.
Las células cancerígenas se encuentran dividiéndose rápidamente con frecuencia, y por lo tanto realizando la síntesis de ADN a las mismas velocidades . La síntesis del ARN es necesaria para la producción de las proteínas. Los antagonistas de pirimidinas inhiben los procesos normales de la síntesis del ADN y/o ARN.
Algunos de los antagonistas de pirimidinas usados en la terapia del cáncer son:
Agentes genotóxicos
Los agentes genotóxicos son fármacos quimioterapeúticos que afectan a los ácidos nucleicos y alteran sus funciones. Estos fármacos pueden unirse directamente al ADN o pueden provocar daños dentro del ADN de indirectamente al afectar las enzimas involucradas en la replicación del ADN. Las células en división rápida son particularmente sensibles a los agentes genotóxicos ya que estas sintetizan moléculas nuevas de ADN con frecuencia. Si el ADN ha sufrido suficientes daños, la célula pasa por la apoptosis, el suicidio celular.
Los tratamientos quimioterapeúticos genotóxicos cuentan con los siguientes agentes:
- Agentes Alquilantes: La primera clase de agentes quimoterapeúticos a los que se acude. Estos fármacos modifican las bases del ADN, interfiriendo con la replicación del ADN y la transcripción, resultando en mutaciones.
- Agentes Intercalantes: Estos fármacos fueron diseñados para intercalarse en los espacios entre nucleótidos de la doble hélice del ADN. Los agentes intercalantes interfieren con la transcripción, la replicación e inducen mutaciones.
- Inhibidores de Enzimas: Estos fármacos inhiben a enzimas claves, tales como las topoisomerasas que son esenciales en la replicación del ADN, induciendo daño al ADN.
La meta del tratamiento con cualquiera de estos agentes genotóxicos, es la inducción de daños dentro del ADN de las células cancerígenas. Si el daño al ADN es lo suficientemente severo, las células son propensas a pasar la por apoptosis, el término equivalente del suicidio celular. Los fármacos quimioterapeúticos genotóxicos afectan a las células cancerígenas y normales. La selectividad de la acción del fármaco se basa en la sensitividad que tienen las células que pasan por divisiones rápidas, como las células cancerígenas y algunas células normales. Este mecanismo de acción explica la ocurrencia de varios efectos adversos de los tratamiento con estos agentes. Las células que se dividen rápidamente, tales como aquellas que forran el intestino o las células madres de la médula ósea, a menudo mueren en conjunto con las células cancerosas. Además de ser citotóxicos (venenos celulares), estos agentes también son mutagénicos, (causan mutaciones) y carcinogénicos (causan cáncer). El tratamiento con estos agentes carga consigo el riesgo de cánceres secundarios, tales como leucemia. Estos fármacos son usados para tratar una variedad de cánceres sólidos y cánceres de las células sanguíneas, a menudo en combinación con otros medicamentos.
¿Cómo funcionan los Agentes Alquilantes?
Los agentes alquilantes emplean tres mecanismos distintos que concluyen de la misma manera: la interrupción de la función del ADN y la muerte celular.
El primer mecanismo consta en la unión entre grupos alquilos (compuestos de carbono pequeños representados por triángulos rosas) y bases del ADN inducida por un agente alquilante (representado en la figura debajo por una estrella rosada). Esta alteración resulta en la fragmentación del ADN por enzimas de reparación en un intento de reemplazar las bases alquiladas (tercer cuadro del diagrama debajo). Las bases alquiladas impiden la síntesis del ADN y la transcripción del ARN, todo por causa de las alteraciones en el ADN.
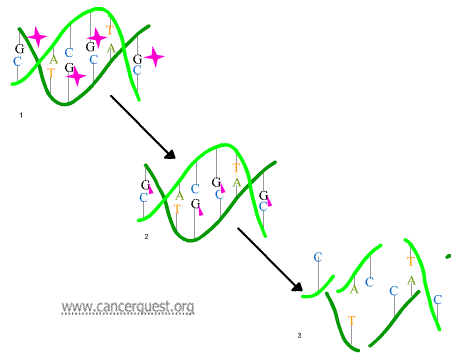
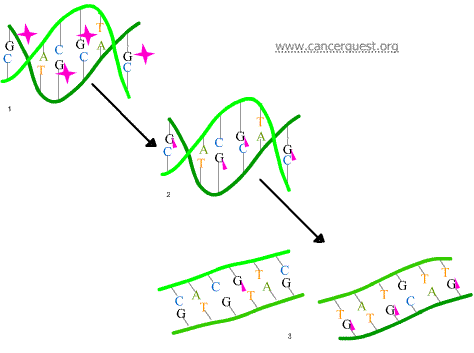
Un segundo mecanismo empleado por los agentes alquilantes para provocar daños en el ADN es la formación de puentes-cruzados, uniones entre átomos en el ADN (de color rosa en el siguiente diagrama). En este proceso, un agente alquilante con dos sitios de unión produce vínculos entre las bases. Los puentes pueden existir dentro de una sola molécula de ADN (como se muestra debajo) o como una conexión entre dos moléculas disntinas de ADN. Estos enlaces cruzados impiden que el ADN se separe para la síntesis o la transcripción.

El tercer mecanismo de acción de los agentes alquilantes consta en la unión errónea de nucleótidos, lo cual induciendo la producción de mutaciones. En una doble hélice normal de ADN, la adenina siempre se emparejará con (está al frente) la timina, mientras que la guanina debe emparejarse con la citosina. Como se muestra en la siguiente ilustración, las bases de guanina alquiladas pueden emparejarse erróneamente con bases de timina. Si este emparejamiento alterado no se corrige, una mutación permanente podría formarse.
Para información sobre un agente particular, haga click en los siguientes enlaces:
Busulfan
Bendamustine
Carboplatin
Carmustine
Chlorambucil
Cisplatin
Cyclophosphamide
Dacarbazine
Daunorubicin
Decitabine
Doxorubicin
Epirubicin
Etoposide
Idarubicin
Ifosfamide
Irinotecan
Lomustine
Mechlorethamine
Melphalan
Mitomycin C
Mitoxantrone
Oxaliplatin
Temozolomide
Topotecan
Inhibidores del huso mitótico
Algunos inhibidores del huso mitótico se emplean como medicamentos quimioterapeúticos A diferencia de los otros agentes descritos previamente, estos fármacos no alteran la estructura ni la función del ADN, pues su función consta en interferir con el mecanismo de la división celular.
Durante la mitosis, el ADN de la célula se replica, y la célula se divide en dos células nuevas. El proceso de separar los cromosomas replicados entre las dos células utiliza las fibras del huso. Estas fibras están compuestas por microtúbulos, que se unen a los cromosomas replicados y halan una copia hacia cada lado de la célula en división, tal como se demuestra en la siguiente animación. Sin estas fibras del huso funcionales, la célula no logra dividirse y eventualmente muere. Los agentes inhibidores del huso funcionan a través de un mecanismo dependiente del ciclo celular, deteniendo la división durante la mitosis temprana. 6
Los microtúbulos que componen las fibras del huso están hechos de cadenas largas de subunidades pequeñas de proteínas denominadas tubulinas. El proceso del crecimiento del microtúbulo (polimerización) se ilustra a seguir. Como se puede observar en la animación, el proceso es dinámico y las subunidades de tubulinas pueden ser añadidas o caerse de los microtúbulos.
Algunos tipos de inhibidores del huso se unen a los monómeros de tubulina y suspenden la formación de los microtúbulos. Al formar un complejo con los monómeros de tubulina, la detención de la formación de los microtúbulos provoca la inmobilidad de los cromosomas durante la mitosis.
La mayoría de los inihbidores del huso afectan a células cancerosas y normales, y por ende, pueden causar efectos secundarios no deseados.
Los vinca alcaloides son un conjunto de drogas derivadas de la planta del bígaro, Catharanthus roseus (también de la Vinca rosea, Lochnera rosea, y la Ammocallis rosea). A esta planta también se la conoce como el bígaro de Madagascar o el bígaro rosa. Tradicionalmente, la planta del bígaro se ha utilizado para tratar una variedad de enfermedades; recientemente, se la ha empleado con más frecuencia debido a sus propiedades anticancerosas. La planta crece en regiones templadas alrededor del mundo, específicamente en el sureste de los EEUU. Su "flor" se presenta en un rosa pálido con un punto violeta obscuro en el centro.7
Todos los vinca alcaloides se administran intravenosamente (IV). Después de la inyección, estos se metabolizan en el hígado y luego se los excreta. Los vinca alcaloides se caracterizan por su especificidad al ciclo celular, lo cual detiene la mitosis de las células afectadas y consecuentemente provocando su muerte. Para reiterar, el mecanismo involucra la unión a los monómeros de tubulina, impidiendo que los microtúbulos (fibras del huso) se formen. Aunque esta planta tiene usos medicinales, puede producir efectos secundarios serios si es fumada o ingerida.
Ejemplos de fármacos que interfieren con la actividad de los microtúbulos:
- Taxanos
- Epotilones
- Vinca Alcaloides
El Descubrimiento del Paclitaxel
Los Doctores Monroe E. Wall y Mansukh C. Wani descubrieron paclitaxel (Taxol®) en el Instituto de Investigación de Triangle en el año 1967. Ellos aislaron el compuesto del árbol Tejo del Pacífico (Taxus brevifolia) y lo probaron como un fármaco anti-tumor en roedores. El mecanismo de acción del paclitaxel fue reportado por científicos del Colegio Médico Albert Einstein en 1980. En diciembre del 1992, la FDA aprobó el uso del paclitaxel en el tratamiento del cáncer de ovario. Hoy en día, este fármaco se utiliza para tratar una vairedad de cánceres, incluyendo al cáncer de ovario, de seno, de pulmón, y el sarcoma de Kaposi.8 El paclitaxel es un alcaloide de una planta que se deriva de la corteza del Tejo del pacífico (ver foto). El tejo del pacífico crece en suelos húmedos y se puede encontrar en la Columbia Británica, en los estados de Alaska, California, Idaho, Montana, Oregon, y en Washington. Se requieren alrededor de 2 g de paclitaxel (provenientes de 3 a 10 árboles) para tratar a un paciente. El paclitaxel se obtiene a partir de una proceso semi-sintético del árbol de Tejo inglés, Taxus baccata. El paclitaxel se administra a través de una serie de inyecciones intravenosas.9

Fuente de la imagen: Wikimedia Commons
Otros agentes quimioterapeúticos
Mientras varios agentes quimoterapeúticos comunes pertenecen a una las tres categorías previamente descritas (genotóxico, citoesqueletal y antimetabolito), algunos de ellos funcionan por medio de mecanismos que no encajan en ninguna de estas categorías. Adicionalmente, algunos agentes pueden no tener un mecanismo de acción claramente definido. Algunos de los medicamentos que caen en estas categorías se encuentran en el listado a continuación:
Hidroxiurea
Estreptozocina
Trióxido de Arsénico (Trisenox®)
- 1ab Hurley LH. "DNA and its associated processes as targets for cancer therapy." Nat Rev Cancer (2002). 2(3): 188-200. [PUBMED]
- 2 Walsh, Declan. Palliative Medicine. 1st ed. Philadelphia: Saunders, 2009.
- 3 Kaye SB. "New antimetabolites in cancer chemotherapy and their clinical impact." Br J Cancer. 1998;78 Suppl 3:1-7. Review. [PUBMED]
- 4ab Matherly LH. "Molecular and cellular biology of the human reduced folate carrier." Prog Nucleic Acid Res Mol Biol. 2001;67:131-62. Review. [PUBMED]
- 5abc Physician's Desk Reference, 56th ed., 2002. Medcial Economics: Thomson Healthcare.
- 6 Schwartz AL, Ciechanover A. "The ubiquitin-proteasome pathway and pathogenesis of human diseases." Annu Rev Med (1999). 50:57-74. [PUBMED]
- 7 Synder, Lucy. "Description and Natural History of the Periwinkle." University of Texas, Institute for Cellular and Molecular Biology. November 1997. [http://biotech.icmb.utexas.edu/botany/perihist.html]
- 8 Fact Sheet: RTI's Discovery of Taxol. Research Triangle Institute. 2001. (March 2002). [http://www.rti.org/page.cfm?objectid=71215B17-D95B-46E8-8BBCA18016AFF167]
- 9 Sally J. DeNardo, Gerald L. DeNardo, Arutselvan Natarajan, Laird A. Miers, Allan R. Foreman, Cordula Gruettner, Grete N. Adamson, and Robert Ivkov. "Thermal Dosimetry Predictive of Efficacy of 111In-ChL6 Nanoparticle AMF Induced Thermoablative Therapy for Human Breast Cancer in Mice." Journal Nuclear Medicine 2007 48: 437-444. [PUBMED]
