Escuche la charla del Dr. Adam Marcus acerca de la metástasis.
El desarrollo de las terapias dirigidas representa un nuevo e interesante enfoque en el tratamiento del cáncer. Mientras que algunos medicamentos ya han sido aprobados por FDA, muchos otros se encuentran bajo investigación mediante ensayos clínicos.
En el mes de agosto del 2017, un grupo de investigadores del centro de cáncer de la Universidad de Colorado (University of Colorado Cancer Center) realizó un estudio con varios pacientes de cáncer al pulmón. Los científicos se enfocaron en la supervivencia general de los pacientes además de su supervivencia libre de progresión, el tiempo transcurrido en el cual la condición de los pacientes no ha empeorado. Se halló que "con el uso de inmunoterapias, los pacientes reaccionaron con más eficacia, y por ende presentaron buenos resultados; mientras tanto, se observaron aun mejores resultados con el uso de las terapias dirigidas en contra del cáncer ALK+". Esto indica que los datos numéricos de su estudio con pacientes de cáncer pulmonar sugieren que mientras más fuerte y eficaz sea la reacción corporal del paciente, más largo será el tiempo en el cual la terapia ejerce sus efectos. Esta conclusión implica que la fuerza y la eficacia de la reacción corporal a la terapia podría facilitar la toma de la decisión relevante a las opciones de tratamiento, tanto para los doctores como para los mismos pacientes.
Temas que tratan en esta página:
- Las terapias dirigidas vs la quimioterapia tradicional
- Inhibidores de quinasas: las quinasas son enzimas que forman uniones entre los grupos fosfato y otras proteínas. Ya que estas controlan muchos procesos celulares, su actividad anormal puede resultar en el desarrollo del cáncer.
- Las funciones de las quinasas
- Las quinasas y el cáncer
- Tratamientos con anticuerpos: Los anticuerpos son proteínas naturales pertenecientes al sistema inmune. Existe una variedad de anticuerpos sintetizados en el laboratorio que se emplean en el tratamiento de varios cánceres.
- La estructura del anticuerpo
- Tipos de anticuerpos
- El uso de los anticuerpos en el tratamiento del cáncer
- Tratamientos de cáncer a base de anticuerpos
- Herceptin
- Inhibidores de la angiogénesis: la angiogénesis, el proceso de formación de los vasos sanguíneos, es crítica para el crecimiento de casi cualquier tipo de cáncer.
- Inhibidores de Proteosomas: los proteosomas son los responsables por la destrucción de proteínas, por lo cual la inhibición de su actividad puede ser utilizada para tratar algunos tipos de cáncer.
- Bloqueadores de receptores moleculares: la comunicación celular ocurre dentro de cada célula y entre las mismas células. La comunicación celular anormal puede llevar al desarrollo de cáncer, por lo cual algunos tratamientos están diseñados para interferir con la transmisión de este tipo de mensajes.
- Las acetiltransferasas y las desacetilasas de histonas (abreviadas como HATs y HDACs por sus siglas en inglés): el ADN sirve como un plano para la actividad celular. El acceso a esta información es controlado por las modificaciones que se pueden presentar en el ADN, incluyendo la adición o remoción de pequeños grupos químicos (grupos acetilo) a o de las proteínas unidas al ADN.
- Los inhibidores de la desacetilasa de histonas (HDAC): la adición y remoción de grupos acetilo en las histonas lleva a modificaciones patrón críticas para la actividad del ADN. La manipulación de este "código de histonas" puede ser utilizada para tratar el cáncer.
- Los fármacos con moléculas anti-sentido del ARN: el ARN anti-sentido es capaz de interferir con la actividad de los mensajeros (ARNm) productos de la transcripción del ADN
- Las ribozimas: las ribozimas son un tipo de ARN que actúan como enzimas al ser biocatalizadores. A diferencia a las enzimas a base proteínas, las ribozimas no se han estudiado con tal profundidad.
- Los activadores de enzimas: el cáncer puede ser el resultado de la desactivación de algunas enzimas críticas. Algunos tratamientos se enfocan en reactivar a estas enzimas.
- Conozca el flujo: Terapia Dirigida
Vea la entrevista con el Dr. Alex Adjei.
Tal vez uno de los temas más prometedores en el desarrollo de medicamentos para el cáncer es la dirección de estos fármacos hacia los procesos específicos a la célula cancerígena en lugar de enfocarse en los procesos comunes que afectan a todas las células. Dado que estos medicamentos contienen una cantidad mínima de elementos tóxicos, y que sólo afectan a las células cancerígenas, su especificidad y la carencia de efectos secundarios brindan esperanzas.1 No obstante, la especificidad de los medicamentos actuales tiene sus desventajas. Mientras que el bloqueo de una sola vía metabólica de la célula cancerígena podría bastar para desacelerar su proliferación, no es suficiente para matarla. Es por esto que actualmente se emplean varios medicamentos específicos en conjunto con la quimioterapia tradicional. La combinación de estos fármacos altamente específicos y capaces de atacar una debilidad del tumor en particular, con la quimioterapia estándar que proporciona un poderoso ataque al tumor, puede ser una excelente forma de tratar el cáncer. Esta sección ofrece algunos ejemplos de medicamentos que han sido o están siendo desarrollados para dirigirse exclusivamente a procesos específicos del cáncer para así dejar intactas a las células normales.
Terapias Dirigidas vs Quimioterapia Convencional
El Dr. Fadlo Khuri explica la diferencia entre quimioterapia y terapia dirigida. Haga clic aquí si desea ver la entrevista completa con el Dr. Fadlo Khuri.
Las células cancerígenas y las células normales tienen mucho en común en cuanto a la maquinaria interna que les permite llevar a cabo las actividades necesarias para mantenerse vivas. Los medicamentos quimioterapéuticos se enfocan específicamente en aquellos procesos que las células cancerígenas necesitan para crecer y dividirse, como la replicación del ADN por ejemplo. Sin embargo, muchas células normales, como las del tracto digestivo, también necesitan replicarse a velocidades rápidas. Por lo tanto, al ser tóxica para las células cancerígenas, la quimioterapia también puede llegar a ocasionar daños en las células sanas. Es por esto que el uso de fármacos quimioterapéuticos tradicionales produce muchos efectos secundarios generalmente severos. Además, a veces estos efectos secundarios son la causa por la cual los pacientes no logran recibir las dósis suficientes para tratar al cáncer eficazmente. Aunque los fármacos quimioterapéuticos son bastante efectivos para tratar a varios tipos de cáncer, los investigadores han estado trabajando arduamente para producir medicamentos que se dirijan a los procesos específicos de las células cancerígenas con fines de prevenir daños en las células normales. El colectivo de conocimientos acerca de las diferencias entre células normales y células cancerígenas ha permitido el desarrollo de tratamientos dirigidos a actividades específicas del cáncer.
Uno de los cambios fundamentales que experimentan las células cancerígenas es la presencia de mutaciones en los genes responsables por el crecimiento celular, los oncogenes. Las proteínas defectuosas producidas por estos genes alterados son las principales candidatas para los enfoques de las terapia dirigidas. Por ejemplo, algunos tipos de cáncer son causados en parte por proteínas mutantes que envían señales celulares que provocan la división celular a frecuencias constantes. Aquellos medicamentos que únicamente bloquean la actividad de las proteínas mutantes, es decir que no interfieren con la actividad de las proteínas normales, ejercerían sus efectos exclusivamente en las células cancerígenas, dejando intactas a las células sanas. Por otra parte, algunos tipos de cáncer son el resultado de la desactivación de genes que normalmente previenen el crecimiento celular, los genes de supresión tumoral. Por ende, los fármacos que logran restaurar la actividad de estas proteínas, podrían reparar los daños presentes en las células cancerígenas, teóricamente, sin afectar a las células normales.
Inhibidores de quinasas
La función de la quinasa en la célula
Las quinasas son un gran grupo de enzimas que regulan la actividad de otras proteínas y de forma menos directa, la actividad de las células. Todas las quinasas adhieren grupos fosfato a otras moléculas, generalmente a proteínas dentro de la célula. La fosforilación de proteínas, es decir, la adición de un grupo fosfato a una de las cadenas de un aminoácido 2 , es una acción regulatoria importante. Ya que cada grupo fosfato cuenta con dos cargas negativas, la adición de un grupo fosfato puede provocar un cambio en la estructura de la proteína. La alteración estructural de una proteína generalmente altera la actividad de la misma. La alternación entre dos versiones distintas de la misma proteína por ende sirve como un mecanismo de regulación de la actividad protéica . La fosforilación mediante las quinasas es un proceso reversible ya que las proteínas pueden ser desfosforiladas (remoción del grupo fosfato) por un grupo de enzimas denominadas fosfatasas.2 Estos dos tipos de enzimas funcionan generalmente a la par para "encender y apagar" las señales celulares. Por estas razones, las quinasas tienen un papel importante en muchas rutas de señalización intracelular, incluyendo aquellas que controlan el crecimiento y la división celular.

Las quinasas son una especie de enzima (máquinas moleculares) que adicionan grupos fosfatos provenientes del ATP (ilustrado en verde) a las moléculas de objetivo. Existen varios tipos de quinasas.

En el cáncer, se presentan daños (mutaciones) con frecuencia en las quinasas, manteniéndolas activas continuamente. La actividad constante de las quinasas puede estimular el crecimiento y la supervivencia celular.

Las quinasas y el cáncer
Las rutas del crecimiento y del ciclo celular se encuentran activas continuamente en las células cancerígenas. Las acciones regulatorias que llevan a cabo las quinasas/fosfatasas no funcionan correctamente en estos casos. Una de las características clave de las células cancerígenas es su habilidad de reproducirse en la ausencia de señales externas tales como los factores de crecimiento. En el proceso normal, los factores de crecimiento secretados por otras células se unen a los receptores ubicados sobre las superficies celulares, estimulando así la división de la célula. Mientras tanto, las células cancerígenas logran activar este proceso en la ausencia del factor de crecimiento. Esto puede ocurrir debido a una mutación en el gen que produce la quinasa o a la fosfatasa. Un ejemplo de esto se observa en la leucemia mieloide crónica, en la cual se ha identificado una translocación cromosómica (cromosoma Philadelphia) que ocasiona la formación de una quinasa que se encuentra activa todo el tiempo. Por lo tanto, la ruta controlada por esta quinasa se mantiene activa, conllevando a la proliferación de las células cancerígenas.
Se han diseñado varios tratamientos nuevos contra el cáncer para inhibir las quinasas activadas por aberraciones en las células cancerígenas con la finalidad de prevenir la división celular. Los siguientes medicamentos son inhibidores de quinasas utilizados para tratar el cáncer:
- Sorafenib (Nexavar®)
- Imatinib (Gleevec®, Glivec®)
- Gefitinib (Iressa®)
- Lapatinib (Tykerb®)
- Dasatinib (Sprycel®)
- Nilotinib (Tasigna®)
- Temsirolimus (Toricel®)
- Erlotinib (Tarceva®)
Anticuerpos
Los anticuerpos son una clase de proteínas producidas por los linfocitos B (células B), una especie de células inmunológicas. Dentro del cuerpo humano, los anticuerpos se adhieren a ciertas moléculas (antígenos) presentes en cuerpos extraños que entran al organismo, como el polen o las bacterias. La mayoría de antígenos son proteínas. Los anticuerpos también pueden unirse a antígenos que se encuentran en la superficie de otras células, tal como las células cancerígenas. La unión de un anticuerpo a un antígeno adherido a una célula o un cuerpo extraño, sirve como un mecanismo de señalización para que el sistema inmune destruya y elimine a estos cuerpos extraños.3
La interacción entre el anticuerpo y el antígeno es muy precisa, pues es análoga a la interacción entre una llave y una cerradura. Cada célula B produce un solo tipo de anticuerpo, por lo cual nuestras células contienen millones de diferentes variaciones de estos linfocitos. Como resultado, existen bastantes tipos de anticuerpos en nuestros cuerpos. De hecho, nuestros cuerpos tienen la habilidad de responder a cada uno de los miles o millones de diferentes antígenos a los cuales nos exponemos durante nuestras vidas. Cuando una célula B se encuentra con su antígeno correspondiente, ésta se reproduce para crear una gran cantidad de clones celulares. Varias de estas células nuevas viven por un largo tiempo, inclusive años después del encuentro con el antígeno, brindando un cierto mecanismo de memoria al sistema inmune. Por ende, una segunda exposición al mismo antígeno lleva a una respuesta más rápida y fuerte. Esta memoria a largo plazo es la base de las vacunas. Mientras tanto, el resto de las células tienen una vida corta y producen una gran cantidad de anticuerpos.4 3
Tal como se demuestra a continuación, los anticuerpos están compuestos por cuatro proteínas, dos cadenas largas y dos cortas, ilustradas en morado. Los anticuerpos están estructurados en forma de Y, con lados idénticos para que el anticuerpo pueda juntarse a dos copias de su molécula de objetivo, una por cada brazo corto de la Y.
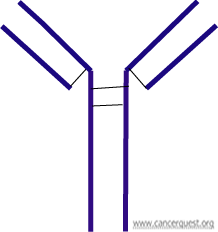
Cualquier antígeno puede inducir la activación de múltiples tipos de células B y la producción consecuente de varios anticuerpos diferentes, procesos dirigidos hacia diferentes partes del mismo objetivo. Una mezcla de diferentes anticuerpos se conoce como anticuerpos policlonales.
Dentro de los laboratorios se puede producir y purificar a grandes cantidades de un solo tipo de anticuerpo, producidos por un solo tipo de células B. Estos anticuerpos se conocen como anticuerpos monoclonales. Hasta la fecha, los tratamientos basados en anticuerpos desarrollados solamente utilizan anticuerpos monoclonales.4 3
La estructura de los anticuerpos
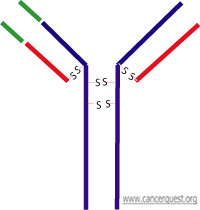
Todos los anticuerpos (también conocidos como inmunoglobulinas o Ig) comparten algunas características comunes. Cada anticuerpo contiene dos proteínas pequeñas (cadenas ligeras) y dos proteínas grandes (cadenas pesadas). Las cuatro proteínas que forman el anticuerpo se unen entre si mediante enlaces disulfuro (S-S) entre cisteínas (aminoácidos). Cada una de las cuatro cadenas del anticuerpo contiene una región invariable y una región variable. La región invariable contiene varios dominios estructurales que permiten que otras células del sistema inmunológico reconozcan al anticuerpo. Las piezas rojas y pequeñas representan las cadenas ligeras y las piezas azules representan las cadenas pesadas. Debajo también se ilustran los enlaces disulfuro (S-S) que unen a la molécula.
Tipos de anticuerpos
Existen cinco categorías de anticuerpos, a las cuales se les denomina isotipos. El isotipo de un anticuerpo es determinado por su región invariable. Los cinco tipos de anticuerpos son: IgG, IgD, IgA, IgE y IgM; cada isotipo se asocia a una respuesta inmune distinta. Por ejemplo, los anticuerpos del isotipo IgG generalmente reclutan células T citotóxicas (asesinas), que destruyen a células de objetivo. El anticuerpo mostrado en la figura de arriba es un isotipo IgG1.
Las regiones variables de los anticuerpos reconocen y se unen a antígenos específicos. Es posible que múltiples anticuerpos provenientes de distintos tipos de células B reconozcan al mismo objetivo específico. Por ejemplo, un invasor bacteriano tendría muchas proteínas de objetivo sobre su superficie, facilitando el reconocimiento de parte varios anticuerpos distintos en el organismo. Incluso una sola proteína (u otro tipo de antígeno) puede ser reconocida por diferentes anticuerpos.
Las reacciones inmunes de los anticuerpos
Los anticuerpos policlonales surgen cuando el organismo detecta la presencia de un antígeno extraño y las células B se activan para producirlos. El resultado es una mezcla de anticuerpos que entre todos reconocerían a diferentes partes del antígeno.
Los anticuerpos monoclonales son aquellos que se derivan de un sólo tipo de célula B. Los anticuerpos monoclonales actualmente se emplean como fármacos anti-cáncer.
El uso de los anticuerpos en el tratamiento del cáncer
Nuestro sistema inmune realiza su trabajo bastante bien. A veces, nuestro sistema inmune logra eliminar a varias células anormales antes de que pasen a desarrollarse en cáncer. Desafortunadamente, muchas de las células cancerígenas no logran ser reconocidas por el sistema inmune ya que estas provienen de células normales. Aunque estas células se comporten como organismos extraños en nuestros cuerpos, las células cancerígenas no estimulan reacciones inmunes fuertes. El uso del sistema inmune y sus productos en el tratamiento del cáncer ha producido resultados prometedores.
Los anticuerpos pueden ser utilizados para inhibir el crecimiento de las células cancerosas de varias maneras:
- Bloqueo de receptores: Estos anticuerpos bloquean las señales celulares necesarias para inducir el crecimiento.
- Anticuerpos que estimulan la muerte celular: Estos anticuerpos detectan la presencia de ciertas proteínas sobre la superficie de las células cancerígenas y las marcan para su destrucción subsiguiente mediante las células inmunológicas. Este proceso se conoce como la citoxicidad mediada por anticuerpos (ADCC- toxicidad celular dependiente de anticuerpos).3
-
Inmunotoxinas: Los anticuerpos atraen a moléculas tóxicas hacia las células cancerígenas. Estas moléculas tóxicas pueden ser proteínas que inhiben actividades celulares, compuestos radioactivos que causan daños en el ADN o la inducción de la apoptosis.
El primer tipo de acción se ilustra en el gráfico a seguir. Para reiterar, los anticuerpos son bastante específicos en cuanto a sus objetivos, y pueden bloquear las interacciones entre las proteínas y moléculas de señalamiento celular. En el diagrama, se pueden ver dos tipos de señales estimulantes del cáncer; la primera es el resultado de la interacción entre dos proteínas sobre la superficie de la célula cancerígena mientras que la segunda se induce cuando otra señal externa se adhiere a un receptor (como una antena) sobre la superficie de la célula cancerígena.
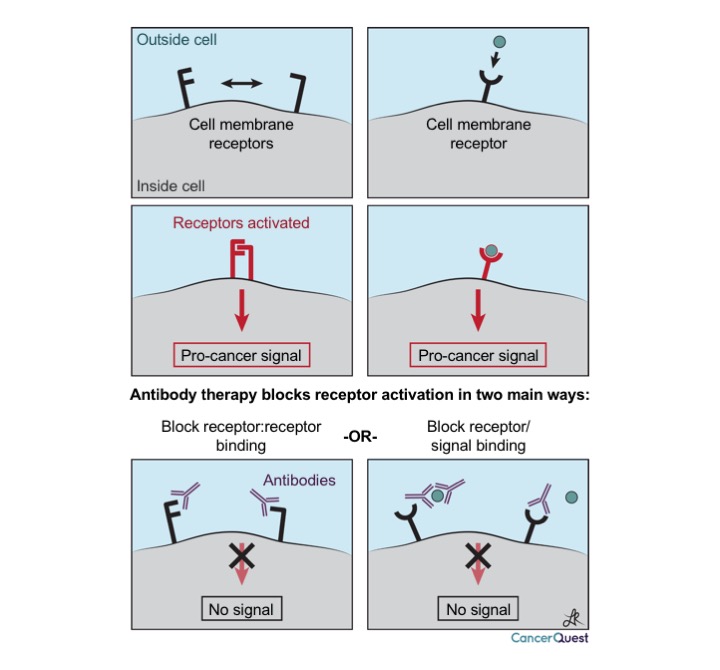
El siguiente gráfico ilustra más maneras por las cuales los anticuerpos se deshacen de las células cancerígenas.

Tratamientos a base de anticuerpos
Existen varios tratamientos con anticuerpos citotóxicos que se usan para tratar tipos particulares de cáncer; además, muchos medicamentos se encuentran en procesos de desarrollo o evaluación . Algunos anticuerpos ya aprobados para su uso en el tratamiento del cáncer incluyen:
Bexxar® (tositumomab)
Campath® (alemtuzumab)
Herceptin® (trastuzumab)
Mylotarg® (gemtuzumab)
Rituxan® (rituximab)
Zevalin® (ibritumomab)
Bexxar® (tositumomab)
Erbitux® (cetuximab)
Vectibix® (panitumumab)
La sección a seguir acerca de los Inhibidores de la Angiogénesis contiene más información sobre otro tratamiento a base de anticuerpos - Avastin®.
Glosario de tratamientos con anticuerpos - Encuentre aquí una tabla que detalla de manera simple y comprensible, los tratamientos a base de anticuerpos en cuanto a sus clasificaciones y a sus nombres comerciales y genéricos. Se proveen enlaces a sitios web con más información.
Herceptin®
Muchos tumores sobreproducen la cantidad de proteínas necesarias para el crecimiento y la división celular. Por ejemplo, en algunos casos de cáncer de seno y de ovarios se presenta la sobreexpresión de la proteína receptora HER2. En tales condiciones en las que este receptor se encuentra sobreexpresado, el Herceptin® puede ayudar a prevenir el crecimiento de tumores primarios y metastásicos.
El Herceptin® es un anticuerpo monoclonal específicamente fabricado para unirse a la proteína HER2. Se desconoce la mecánica exacta del Herceptin® al momento de detener del crecimiento tumoral, sin embargo existen evidencias que indican que puede tratarse de más de un mecanismo de acción.5 Se presume que el Herceptin® logra impedir el crecimiento de tumores al inhibir la unión entre las moléculas de señalización celular estimulantes del crecimiento con los receptores sobre la superficie de la célula.
El Herceptin® también puede inducir la citotoxicidad dependiente de anticuerpos (ADCC) además de otros mecanismos similares. 6 7
Inhibidores de la angiogénesis
Al igual que todas las células, las células cancerígenas requieren un suministro constante de nutrientes y oxígeno para crecer y dividirse; por ende, los tumores no crecen sin que esto ocurra. Para garantizar un suministro suficiente de alimentos, sangre y oxígeno, los tumores producen moléculas estimulantes de la formación de vasos sanguíneos.
El proceso de formación de vasos sanguíneos es conocido como angiogénesis. Una forma de inhibir el desarrollo de vasos sanguíneos consiste en bloquear las señales que provienen del tumor. Las células cancerígenas pueden producir directamente señales que causan la formación de vasos sanguíneos o pueden "engañar" a células no tumorígenas adyacentes para que éstas envíen las mismas señales.
Un posible beneficio de este tipo de tratamiento es la disminución de los efectos negativos (secundarios) en el paciente. La angiogénesis tiene una alta tasa de ocurrencia durante el desarrollo fetal, el ciclo menstrual y la sanación de heridas. Los tratamientos podrían interferir con estos procesos más no dañar a la mayoría de las células normales en proliferación.
A diferencia de la quimioterapia convencional, las células cancerígenas no son eliminadas directamente por el tratamiento. El objetivo de estos tratamientos son los procesos normales controlados por las células normales (como las células que forman los vasos sanguíneos), no las células tumorígenas. Las células cancerígenas son muy inestables pero es poco probable que los objetivos de los medicamentos cambien en presencia de los mismos. Puede que esto haga menos probable que las células cancerígenas se vuelvan resistentes a este tipo de tratamientos.
Actualmente se encuentran bajo investigación otros enfoques para la inhibición de la angiogénesis:
- Inhibidores de las Metaloproteinasas de Matriz: la degradación de la matriz celular que rodea a las células es un proceso importante para la formación de nuevos vasos sanguíneos. Tal como se describe a detalle en la sección metástasis, este proceso es también esencial para la propagación de las células tumorígenas a localizaciones distantes en el cuerpo. Los vasos sanguíneos en crecimiento segregan enzimas llamadas metaloproteinasas de matriz (MMPs), las cuales son capaces de digerir la matriz extracelular para permitir que los vasos sanguíneos invada el área y suministren nutrientes al tumor. La inhibición de este proceso es el objetivo de varios medicamentos.
- Inhibidores de Células Endoteliales: varios nuevos medicamentos se encuentran bajo investigación por inhibir la angiogénesis al evitar el crecimiento o las actividades de las células endoteliales que forman los vasos sanguíneos.
- Inhibidores de la Activación de la Angiogénesis: los medicamentos de este tipo bloquean la cascada de eventos que da lugar a la formación de vasos sanguíneos.
Los medicamentos dirigidos que se encuentran actualmente en desarrollo pueden afectar a más de un objetivo. Algunas veces esto es intencional y en otras es un efecto secundario inevitable del medicamento.
Estos son algunos de los medicamentos aprobados por la FDA que han probado ser funcionales (al menos en parte) al prevenir la angiogénesis:
Inhibidores de proteosomas
Los proteasomas o proteosomas son organelos subcelulares localizados en el citoplasma, núcleo, retículo endoplásmico (RE) y lisosomas de células eucariotas 8 Tienen forma cilíndrica y están compuestos por diversas enzimas proteolíticas (digieren proteínas). Las funciones de los proteosomas incluyen:
- Digestión de proteínas simples
- Digestión de proteínas dañadas o mal plegadas.
- Generación de péptidos que son reconocidos por el sistema inmunitario.
- Regulación del periodo de vida (vida media) celular de proteínas reguladoras como aquellas que controlan el ciclo celular. 9
Más del 80% de las proteínas celulares son procesadas por proteosomas .10
Los proteosomas actúan sobre aquellas proteínas que han sido marcadas como objetivos de degradación mediante la adhesión de otra proteína llamada ubiquitina. Generalmente, estas señales de degradación se localizan dentro de los pliegues estructurales de las proteínas, y se vuelven accesibles cuando la proteína se encuentra incorrectamente plegada o desnaturalizada. Cuando estas señales se encuentran expuestas, otras enzimas adicionan una pequeña proteína (ubiquitina, mostrada como una esfera amarilla). Luego, una proteína receptora en el proteosoma reconoce al complejo formado por la proteína y la ubiquitina, resultando en la introducción del complejo dentro del mismo proteosoma y en su digestión subsecuente. Posteriormente la proteína ya fragmentada es liberada por el proteosoma tal como se muestra a continuación .9
Los proteosomas ejercen control sobre la vida y la defunción de muchas proteínas regulatorias de corta vida, tales como aquellas involucradas en el ciclo celular. Es por esto que una falla en el proteosoma puede conducir a una regulación anormal del ciclo celular y a la proliferación descontrolada de células. El ciclo celular es controlado tanto por señales celulares positivas (estimulantes) como negativas (inhibidoras). Una alteración en las proteínas involucradas en estos controles puede afectar el balance de este proceso, afectando gravemente al desarrollo y a la evolución del cáncer. En una célula normal, los proteosomas degradan a aquellas proteínas que inhiben el ciclo celular como los inhibidores de las quinasas dependientes de ciclinas (CKI) .8
La inhibición de las funciones de los proteosomas provoca un paro en el ciclo celular y por ende la muerte de la célula. Las células tumorígenas son más suceptibles a estos efectos en comparación con las células normales, ya que estas se dividen con más velocidad y a que muchas de sus vías regulatorias se encuentran interrumpidas. Los mecanismos involucrados en las reacciones de las células normales y cancerígenas ante la inhibición del proteosoma aún se desconocen. En general, las células cancerígenas son más vulnerables a los efectos de los inhibidores de los proteosomas y como consecuencia, estos inhibidores podrían representar un tratamiento efectivo para algunos tipos de cáncer. 8
El primer inhibidor de proteosomas sometido a pruebas clínicas como tratamiento para el cáncer fue el PS-341 (ahora: MLN-341). El medicamento fue elaborado por Millenium Pharmaceuticals. Este medicamento interactúa específicamente con un aminoácido (treonina) clave dentro del sitio activo (sitio catalítico) del proteosoma. Aunque esta interacción solamente logra bloquear a una de las tres actividades catalíticas del proteosoma, la inhibición resultante parece ser suficiente para evitar la degradación de proteínas con ubiquitina. 11 El 13 de mayo del 2003, PS-341, ahora conocido como bortezomib o Velcade™, se convirtió en el primer inhibidor de proteosomas aprobado para uso humano en los Estados Unidos. Hoy en día, este fármaco se utiliza para tratar a varios tipos de cáncer sanguíneo. 12
Un segundo inhibidor de proteosomas fue aislado de una bacteria marina. El agente se denomina salinosporin o salinosporamida y actualmente se encuentra bajo estudio. 13
Aprenda más acerca de los inhibidores de proteosomas:
La estructura y la función de los proteosomas
La estructura del proteosoma se relaciona con su misma función. Cada proteosoma consiste de un núcleo central cilíndrico 20S compuesto por cuatro anillos apilados que individualmente contienen siete proteínas. Los 2 anillos exteriores son idénticos y contienen subunidades 'alfa', mientras que los dos anillos intermedios también son idénticos pero contienen subunidades 'beta'. Las funciones de las subunidades beta cuentan con la digestión de proteínas que ocurre dentro del lado interior de la enzima.
El cada extremo del núcleo del proteosoma se encuentra unido a una proteína regulatoria (19S). Las proteínas 19S son responsables por el reconocimiento de proteínas que deben ser degradadas. En un proceso que requiere energía (ATP), las proteínas marcadas son desenvueltas e introducidas al interior del núcleo. Las proteínas después se digieren y pasan a ser péptidos de 6-9 aminoácidos de longitud y subsiguientemente son liberadas. Los peptidos pueden ser reciclados. Las proteínas 19S y 20S constituyen el proteosoma humana.
Los proteosomas y el sistema inmunológico.
Algunos fragmentos digeridos protéicos entran al retículo endoplásmico (RE) donde se unen a las proteínas involucradas en las reacciones inmunológicas. El complejo compuesto por estos péptidos y las proteínas del sistema inmunológico (proteína MHC) es después transportado hacia el exterior de la célula. El complejo luego actúa como molécula de señalización para las células inmunológicas, induciendo una reacción inmune. Un ejemplo de esto se observa en el procesamiento de las proteínas producidas por un virus dentro de una célula infectada.
Bloqueadores de receptores moleculares
Nuestras células monitorean a sus alrededores de manera continua para detectar la presencia (o a veces ausencia) de moléculas reguladoras en el ambiente. Estas moléculas actúan como señales que controlan procesos como la división celular, el movimiento de la misma célula, e inclusive la muerte celular. Esta supervisión del ambiente extracelular se lleva a cabo mediante las proteínas receptoras localizadas en la membrana de la célula, actúando como antenas celulares. Tras la unión de una molécula señal, las moléculas receptoras transmiten información a otras moléculas dentro del citoplasma y del núcleo resultando en una reacción correspondiente. Un ejemplo se observa en el producto del oncogén HER-2/neu , el cual funciona como un receptor de factores de crecimiento. Este gen se detalla más a fondo en nuestra sección sobre oncogenes.14 Muchas enfermedades distintas, como el cáncer, se deben a defectos en la señalización celular. En el cáncer, estas disfunciones pueden llevar a una división celular descontrolada y al desarrollo de tumores. Distintas vías de señalización pueden presentar defectos dependiendo del tipo de cáncer. Los medicamentos diseñados para inhibir estas vías específicas de señalización celular prometen inhibir el crecimiento cancerígeno sin afectar a las células normales. El bloqueo de los receptores es un área activa dentro de la investigación clínica. 14
La inhibición de receptores específicos aún es un área relativamente nuevo, mas a la vez muy prometedora en la investigación médica. No obstante, un posible problema que se podría presentar con los inhibidores de receptores son los efectos secundarios a largo plazo. Los tratamientos son relativamente nuevos, por lo que los efectos secundarios aun no se conocen a profundidad. Hasta la fecha, se ha observado que los efectos secundarios documentados son mucho menos severos en comparación con los tratamientos convencionales de quimioterapia.
Actualmente existen varios fármacos que se unen a las proteínas y a los receptores sobre la superficie celular. Otros antagonistas de receptores específicos se dirigen a receptores de hormonales ubicados dentro de las células. Información acerca de estos inhibidores se puede encontrar en nuestra sección acerca de los Tratamientos contra el Cáncer.
Cáncer de Pecho - Modificadores Selectivos para Receptores de Estrógeno (SERM's)
Cáncer de Próstata - Modificadores Selectivos para Receptores de Andrógenos (SARM's)
Aquellos medicamentos que bloquean el crecimiento de los vasos sanguíneos se encuentran descritos en la sección de inhibidores de la angiogénesis.
Las acetiltransferasas (HATs) y las desacetilasas (HDACs) de histonas
Con algunas excepciones como en los glóbulos rojos, todas nuestras células contienen dos copias completas de nuestro genoma. Cada cromosoma está compuesto por una sola pieza de un ADN de doble cadena que contiene millones o inclusive cientos de millones de pares de nucleótidos. Estas moléculas son muy delgadas y extremadamente largas. Cada célula contiene aproximadamente 2 metros (~6 pies) de ADN. Todo este se ADN debe compactar de tal forma que quepa en el núcleo celular (un espacio muy pequeño). Para lograr lo dicho, el ADN (cargado negativamente) se condensa y se enrolla alrededor de unas proteínas (cargadas positivamente) llamadas histonas15 . Ocho histonas (dos copias de cuatro proteínas distintas) forman un núcleo para que el ADN se envuelva alrededor del mismo. La estructura formada por las histonas y el ADN se conoce como nucleosoma. Cada nucleosoma contiene únicamente alrededor de 150 pares de bases de ADN, por lo que hay miles de estas estructuras a lo largo de la longitud de cada cromosoma. Tal como se muestra en la ilustración a seguir, los nucleosomas se encuentran unidos por pequeños tramos de ADN, aparentando las cuentas a lo largo de un collar. Los nucleosomas pueden condensarse posteriormente en la presencia de proteínas adicionales para formar la cromatina. 16
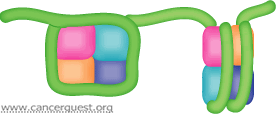
La unión entre un factor de transcripción con su gen objetivo, en parte, depende de las modificaciones que experimentan las histonas. Las enzimas conocidas como acetiltransferasas de histonas (abreviadas como HATs por sus siglas en inglés) alteran la estructura de la cromatina (complejo ADN-proteína) al agregar pequeñas cadenas de carbono a algunas histonas. Esta alteración cambia la interacción estructural del complejo ADN-histona, aflojando la envoltura del ADN, permitiendo así que los factores de transcripción se unan. Otras enzimas llamadas desacetilasas de histonas (HDACs) se encargan de remover los grupos acetilo de las histonas, desactivando con ello la transcripción.
Cuando las histonas son desacetiladas, las cargas positivas son restauradas y el ADN se reúne al nucleosoma de manera compacta. La desacetilación lleva a la represión de la transcripción ya que los factores de transcripción, como los factores de regulación y la polimerasa del ARN, no logran tener acceso al ADN. 17
Se ha observado una actividad anormal de las HDACs en diversos tipos de cáncer, tales como la leucemia promielocítica aguda, leucemia mieloide aguda, linfoma no Hodgkin y algunos tipos de carcinomas colorrectales y gástricos. Cuando estas enzimas funcionan incorrectamente, pueden impedir la transcripción de genes clave. Este proceso parece ser un paso importante en la formación tumorígena de algunos tipos de cáncer. 18 19
Inhibidores de la desacetlilasa de histonas (HDAC)
Varios estudios revelan que los inhibidores de la HDAC alteran el crecimiento de distintas formas de cáncer19 . Se ha demostrado que estas moléculas, muchas de las cuales provienen de fuentes naturales, poseen la capacidad de inhibir la proliferación, inducir la diferenciación y causar la apoptosis en células tumorígenas.
Una característica interesante de estas moléculas es que presentan una baja toxicidad, tal como se observó en ensayos preliminares. Aunque que gran parte de las pruebas con estas terapias ha sido realizada únicamente en cultivos celulares o en modelos animales, los resultados de éstas han sido muy prometedores. Por esta razón, múltiples ensayos clínicos se encuentran en curso. Estos estudios han hallado que los inhibidores de la HDAC afectan a varios tipos de cánceres sólidos y hematológicos, incluyendo al neuroblastoma, melanoma, a la leucemia (incluyendo la leucemia promielocítica aguda y la leucemia mieloide), al cáncer de pecho, próstata, de pulmón, ovario y de colon. 19
Los inhibidores de la HDAC se clasifican en categorías basadas en su estructura química. El mecanismo exacto mediante el cual estos compuestos funcionan no es comprendido aún del todo pero es el enfoque central de la investigación actual. Sin embargo se piensa que cada inhibidor actúa al inhibir una HDAC específica, lo cual tiene un efecto específico en la expresión génica, regulación del ciclo celular, proliferación, diferenciación y apoptosis. Los científicos también presumen que los inhibidores de la HDAC inducen cambios en el citoesqueleto, aportando a la actividad anti-tumorígena. La mayoría de estos fármacos son eficaces a dosis bajas y parecen actuar sobre regiones específicas del genoma, alterando únicamente la transcripción de un grupo particular de genes. La verdadera eficacia de los inhibidores de la HDAC aún se debe corroborar, sin embargo las pruebas han mostrado el potencial de su uso efectivo en tratamientos de algunos tipos de cáncer. Estos medicamentos se pueden administrar en combinación con otros agentes anti-cancerígenos. 19
En el 2006, la FDA aprobó un nuevo inhibidor de la HDAC llamado Vorinostat (Zolinza®)
Fármacos anti-sentido
Tal como se detalla en nuestra sección acerca de la Función Celular, nuestros genes están compuestos por extensas cuerdas de nucleótidos acomodadas a lo largo del ADN en nuestros cromosomas. Cuando se requiere la expresión de un gen, se lleva a cabo el proceso de transcripción que produce una copia de la información genética en forma de una molécula de ARNm.
A diferencia de la estructura de doble cadena del ADN, las moléculas mensajeras de ARN están formadas por una sola cadena. Al igual que las moléculas de ADN, estas moléculas monocatenarias (una cadena) forman enlaces con cadenas complementarias de ácidos nucleicos. Por lo tanto, si otra cadena singular de ácidos nucleicos complementaria a la secuencia del ARNm (secuencia antisentido) entra a la célula, se unirá a ese ARNm específico y lo desactivará. El complejo formado por la unión de las dos cadenas no es viable para la traducción, por lo cual se degrada.
Los oligonucleótidos antisentido son el enfoque de las áreas más nuevas en el desarrollo de medicamentos. Esta tecnología permite que los investigadores se concentren en el proceso celular de su elección con total especificidad. Por ejemplo, si una proteína está contribuyendo al crecimiento cancerígeno, un oligonucleótido antisentido se podría emplear para prevenir que esta proteína sea sintetizada. Ya que los oligonucleótidos antisentido son muy específicos, es poco probable que cualquier otra proteína en el cuerpo se vea afectada. Esta especificidad resultaría en la reducción de los efectos secundarios que se presentan comúnmente en los tratamientos convencionales contra el cáncer. 20
La función del ARN antisentido se ilustra en la siguiente animación. La primera parte de la animación ilustra el proceso normal de la traducción del ARNm (morado) y la segunda parte muestra la unión de un ARN antisentido (rojo) con el ARNm (morado), bloqueando con esto la producción de la proteína.
Aún se desconocen los detalles acerca del mecanismo de esta desactivcación, no obstante puede estar relacionado con el hecho de que las células normales contienen raramente ARN de doble cadena. Ya que las información genérica necesaria para producir una proteína se encuentra en una molécula particular de ARNm, este proceso se puede desactivar al usar estas secuencias complementarias.20
La FDA aún no ha aprobado el uso de medicamentos antisentido, sin embargo muchos ensayos clínicos están en curso para observar de manera preeliminar el uso de agentes dirigidos a diferentes objetivos en diversos tipos de cáncer.21 22 23
Encuentre aquí una lista de las pruebas clínicas que involucran medicamentos antisentido (NCI).
Ribozimas
Las enzimas son catalizadores orgánicos que aceleran las reacciones biológicas, al igual que las enzimas. Aunque la mayoría de las enzimas están compuestas por proteínas, algunas moléculas de ARN, ribozimas, también muestran una actividad catalítica. Las ribozimas participan en una gran variedad de procesos celulares, sin embargo su propiedad más interesante, desde el punto de vista de la terapia contra el cáncer, es su capacidad de cortar moléculas de ARN mensajero (ARNm). Cuando una molécula de ARNm se fragmenta, ya no puede pasar por la traducción, impidiendo la producción de la proteína correspondiente. Al entrar en contacto con las moléculas de ARNm que codifican la producción de proteínas patológicas del cáncer, las ribozimas pueden disminuir o inhibir el crecimiento cancerígeno.
Las ribozimas poseen dos regiones clave en la fragmentación de una molécula ARNm. Una región se une a la secuencia de objetivo en el ARNm y la otra es responsable por la fragmentación. La unión de la ribozima al objetivo requiere una especificidad entre ambas moléculas. Con esto en mente se pueden sintetizar ribozimas dirigidas en contra de estas moléculas de ARNm en particular. Si la secuencia de nucleótidos de un ARNm se conoce, una ribozima que logra fragmentar a esta molécula específica de ARNm se puede elaborar. Los resultados del proyecto del genoma humano pueden ser claves en la identificación de genes/proteínas importantes en el cáncer, facilitando la elaboración de varios tipos de ribozimas. Al atacar a moléculas particulares de ARNm, las ribozimas podrían detener el crecimiento cancerígeno en una variedad de etapas, tal como la proliferación celular, la resistencia a medicamentos y la metástasis.
La siguiente animación ilustra la unión de una ribozima a un ARNm y la fragmentación consecuente.
En el siguiente listado, se incluyen a genes que han servido como dichos objetivos:
- ras - un oncogén que conduce a la proliferación de células cancerígenas.24 25 Más sobre el ras.
- c-fos - codifica la producción de una proteína que promueve la transcripción de otros genes. 17
- MDR1 - codifica la producción de una proteína transmebranal involucrada en la resistencia a medicamentos quimioterapéuticos. 26 27 Más sobre el MDR.
- MMP-9 - enzima involucrada en la metástasis del tumor 28
- VEGFR-1 - un receptor para el factor de crecimiento del endotelio vascular. El tratamiento con la ribozima Angiozyme® (RPI.4610) fue el primer medicamento desarrollado que emplea una ribozima. 29 Su uso fue probado en contra del cáncer de riñón, sin embargo ya no se encuentra en pruebas clínicas.
La FDA no ha aprobado a ningún medicamento con ribozimas.
Encuentre aquí algunas pruebas clínicas de tratamientos a base de ribozimas (NCI).
Vista cercana a las ribozimas
ANGIOZYME, o la angiozima fue la primer ribozima sintética a ser empleada en estudios clínicos con humanos. Esta se elaboró con el propósito de inhibir la angiogenesis al fragmentar al ARNm que produce el receptor del VEGF1 (factor de crecimiento endotelial vascular). Una cantidad reducida de estos receptores podría inhibir la formación de vasos sanguíneos en el tumor y el crecimiento del mismo.
ANGIOZIME fue elaborado por Sirna Therapeutics (corporación que ya no opera) en coloboración con Chiron (farmacéutica comprada por Novartis en el 2006). Han suspendido busquedas adicionales por ahora. 30 Este fármaco fue sometido a algunas pruebas clínicas para tratar a varios cánceres, incluyendo al cáncer de seno y al cáncer de colon. El nivel de toxicidad relacionado al uso del fármaco fue bajo, y la ocurrencia de los efectos secundarios fue infrecuente.31 Desafortunadamente, los resultados de los estudios con la angiozima no fueron muy positivas. Por ende, las pruebas clínicas fueron descontinuadas.
Activadores de enzimas
Las enzimas son proteínas que aceleran las reacciones químicas en el cuerpo. Las enzimas llevan a cabo la síntesis o la degradación molecular necesaria para el crecimiento celular y su mantenimiento. En el siguiente gráfico se ilustra a una enzima que une dos biomoléculas para formar una más grande.
Muchos agentes quimioterapéuticos actúan al inhibir la actividad de enzimas importantes. Algunos ejemplos de agentes que inhiben enzimas incluyen a los inhibidores de la topoisomerasa Irinotecán y Topotecán, entre otros.
La activación de enzimas que normalmente limitan el crecimiento celular también puede disminuir la división celular en los tumores. Un ejemplo de este tipo de medicamento se encuentra listado a continuación:
- Asparaginasa (Elspar®)
Conozca el flujo: Terapia dirigida
Conoce el Flujo, un juego interactivo para probar su conocimiento. Para jugar:
- Arrastre las respuestas correctas de la columna de la derecha y póngalas en orden en las cajas de la izquierda. Dese cuenta de que sólo utilizará cinco de las seis opciones para completar el juego.
- Cuando termine, haga click en Checar para revisar cuántas respuestas contestó correctamente.
- Para respuestas incorrectas, haga click en Descripción para repasar la información sobre los procesos.
- Para intentarlo nuevamente, seleccione Reiniciar y comience de nuevo.
Please visit us on a larger screen to play this game.
- 1Gibbs J. "Mechanism-based target identification and drug discovery in cancer research." Science (2000) 287: 1969-1973 [PUBMED]
- 2 a b Becker, Hardin, Kleinsmith. The World of the Cell. San Francisco: Benjamin Cummings, 2003.
- 3 a b c d Goldsby R, Kindt T, Osborne B. Kuby Immunology. 4th ed. WH Freeman & Company, New York: 2000.
- 4 a b Microbiology and Immunology Online. Produced by the University of South Carolina School of Medicine. Accessed August 26, 2010 [http://pathmicro.med.sc.edu/book/immunol-sta.htm]
- 5Genentech Product Information [http://www.gene.com]
- 6Albanell J, Arribas J, Baselga J, Codony-Servat J, Molina MA, Rojo F. "Trastuzumab (Herpceptin), a humanized anti-HER2 receptor monoclonal antibody, inhibits basal and activated HER2 ectodomain cleavage in breast cancer cells." Cancer Research (June 2001). 61: 4744-4749. [PUBMED]
- 7Barnes M. "Response of metastatic breast cancer to trastuzamab." Lancet (2000). 355: 160-161. [PUBMED]
- 8 a b c Adams J. "Development of the proteosome inhibitor PS-341." The Oncologist (2002). 7: 9-16. [PUBMED]
- 9 a b Schwartz AL, Ciechanover A. "The ubiquitin-proteasome pathway and pathogenesis of human diseases." Annu Rev Med (1999). 50:57-74. [PUBMED]
- 10Geradts J, Ingram CD. "Abnormal expression of cell cycle regulatory proteins in ductal and lobular carcinomas of the breast." Modern Pathology (2000). 13(9): 945-953. [PUBMED]
- 11Adams J. "Proteosome inhibition as a novel approach to cancer therapy." In Detection and Prevention Online. Millenium Pharmaceuticals, Inc. (2002). [http://cancerprev.org/Meetings/2002/Abstracts/1095/447]
- 12Einsele H. Bortezomib Recent Results Cancer Res. 2010;184:173-87. [PUBMED]
- 13Chauhan D, Catley L, Li G, et al. (2005). "A novel orally active proteasome inhibitor induces apoptosis in multiple myeloma cells with mechanisms distinct from Bortezomib". Cancer Cell 8 (5): 407-419 [PUBMED]
- 14 a b Downward, J. "The ins and outs of signaling" Nature (June 14, 2001). 411: 759-762. [PUBMED]
- 15Hua J and Muschel RJ. "Inhibition of matrix metalloproteinase 9 expression by a ribozyme blocks metastasis in a rat sarcoma model system." Cancer Res (1996). 56: 5279-82. [PUBMED]
- 16Ribozyme Pharmaceuticals [http://www.rpi.com]
- 17 a b Scanlon KJ, et al. "Ribozyme-mediated cleavage of c-fos mRNA reduces gene expression of DNA synthesis enzymes and metallothionein." PNAS (1991). 88 (23): 10591-5. [PUBMED]
- 18Marks P, Rifkind RA, Richon VM, Breslow R, Miller T, Kelly WK. "Histone deacetylases and cancer: causes and therapies." Nat Rev Cancer (2001). 1(3): 194-202. [PUBMED]
- 19 a b c d Richon VM, O'Brien JP. "Histone deacetylase inhibitors: a new class of potential therapeutic agents for cancer treatment." Clin Cancer Res (2002). 8(3): 662-4. [PUBMED]
- 20 a b Isis Pharmaceuticals [http://www.isip.com]
- 21Caruso G, Caffo M, Raudino G, Alafaci C, Salpietro FM, Tomasello F. Antisense oligonucleotides as innovative therapeutic strategy in the treatment of high-grade gliomas. Recent Pat CNS Drug Discov. 2010 Jan;5(1):53-69. [PUBMED]
- 22Cassell A, Grandis JR. Investigational EGFR-targeted therapy in head and neck squamous cell carcinoma. Expert Opin Investig Drugs. 2010 Jun;19(6):709-22. [PUBMED]
- 23Patel MP, Masood A, Patel PS, Chanan-Khan AA. Targeting the Bcl-2. Curr Opin Oncol. 2009 Nov;21(6):516-23. [PUBMED]
- 24Ohta Y, et al. "H-ras ribozyme-mediated alteration of the human melanoma phenotype." Ann NY Acad Sci (1994). 716: 242-53. [PUBMED]
- 25Wang CH, Tsai LJ, Tsao YP, Hsieh JT, Chien WW, Liao CL, Wang HW, Liu HS, Chen SL. "Recombinant adenovirus encoding H-ras ribozyme induces apoptosis in laryngeal cancer cells through caspase- and mitochondria-dependent pathways." Biochem Biophys Res Commun. 2002 Nov 15;298(5):805-14. [PUBMED]
- 26Scanlon KJ, et al. "Ribozyme-mediated reversal of the multidrug-resistant phenotype." PNAS (1994). 91(23): 11123-7. [PUBMED]
- 27Nagata J, Kijima H, Hatanaka H, Asai S, Miyachi H, Abe Y, Yamazaki H, Nakamura M, Watanabe N, Mine T, Kondo T, Scanlon KJ, Ueyama Y. "Reversal of drug resistance using hammerhead ribozymes against multidrug resistance-associated protein and multidrug resistance 1 gene." Int J Oncol. 2002 Nov;21(5):1021-6. [PUBMED]
- 28Hua J and Muschel RJ. "Inhibition of matrix metalloproteinase 9 expression by a ribozyme blocks metastasis in a rat sarcoma model system." Cancer Res (1996). 56: 5279-82. [PUBMED]
- 29Weng DE, Usman N. Angiozyme: a novel angiogenesis inhibitor. Curr Oncol Rep. 2001 Mar;3(2):141-6. [PUBMED]
- 30Sirna Therapeutics. "Specialty Programs: Angiozyme." Online. Available. http://www.sirna.com/rnai/specialty.html. Oct. 21, 2004 [http://www.sirna.com/rnai/specialty.html]
- 31Weng DE, Usman N. "Angiozyme: a novel angiogenesis inhibitor." Curr Oncol Rep. 2001 Mar;3(2):141-6. [PUBMED]
