受癌症影响的不止是人类。这一部分包含关于驯养动物的癌症的详细信息。如果您想了解的动物总类/癌症总类没有展示出来,请记得回来查看,因为我们会定期添加新的信息。关于本页主题的更多信息也可以在大多数生物学入门教科书中找到。我们推荐一本名叫坎贝尔生物学(Campbell Biology)的第11版教科书。1
宠物癌症
根据 American Veterinary Medical Association(美国兽医协会) (AVMA), 在10岁以上的宠物中,癌症几乎造成50%的死亡。宠物常见的癌症包括:皮肤癌,睾丸癌,腹部癌和骨癌。常见于宠物身上的癌症也常见于人类,如淋巴瘤,黑色素瘤和骨肉瘤。2 3
在两种最常见的家庭宠物中,狗比猫更容易患癌症。根据癌症的类型,癌症是可以治疗的。狗和猫的癌症治疗方与人类相似。手术,放射治疗,化疗和免疫治疗都被考虑在哪。通常动物的副作用要比人类要少一点。兽医将调整治疗剂量,以优化疗效和减少副作用。3
目录:
猫的癌症
猫容易患有多种癌症,其中最常见的是淋巴瘤、鳞状细胞癌(皮肤癌)、乳腺癌、肥大细胞癌、口腔肿瘤、纤维肉瘤(软组织癌)、骨肉癌(骨癌)、呼吸癌、肠腺癌和胰腺。这些疾病现在已经变得非常严重,很多人普遍认为它是猫最常见的死亡原因。4
某些品种比其他品种更容易患某些癌症。根据癌症的类型和阶段,症状和体征也会不同。检测和诊断需要些检测工作。可见和/或可触摸到的肿瘤最容易识别。兽医经常进行额外的检查以作出准确的诊断。除了身体检查外,它们还可能进行血液和尿液检查、细胞学检查、影像学检查和活检。
治疗方法多种多样,包括手术、化疗、放疗、免疫疗法、光动力疗法或这些疗法的结合。在许多情况下,癌症可以得到成功的治疗。早期发现和诊断是至关重要的。定期拜访兽医可以帮助预防和管理癌症。美国兽医协会建议所有猫每年进行两次健康检查。5 因为猫患癌症的原因与人类相似,降低猫接触有害致癌物(包括烟草烟雾)的风险可以降低。6
猫白血病和猫白血病病毒
概述以及传播
在人类中,有些病毒会导致癌症。一个例子是人类乳头状瘤病毒(HPV),它是大多数宫颈癌的病原体。病毒感染也会导致动物癌症。猫白血病(FeLV;俗称“feleuk”)是一种RNA病毒(一种逆转录病毒),在美国感染健康家猫的比例不到2%。7 8 感染在高风险人群中更为普遍(即有户外活动和/或频繁社交活动的猫)。7
病毒通过唾液、鼻腔分泌物、粪便和乳液从一只猫传播到另一只猫。9 10 它通过各种形式的接触传播,从友好的梳理时的过程到不那么友好的咬人。这种病毒也可以在怀孕期间传染给发育中的小猫。感染的年龄和时间影响病毒的进展和临床结果。小猫更容易被感染,更容易出现更严重的并发症。在大多数情况下,FeLV最初会感染咽喉后部(口咽部)的淋巴细胞。这些淋巴细胞会传播到骨髓,在那里病毒感染细胞的产生非常迅速。11
在大多数环境中,猫白血病病毒在宿主之外无法存活很长时间。它可以用肥皂和消毒剂“杀死”(无害)。目前,没有研究表明FeLV可以从感染的猫传染给人类。12 然而,由于FeLV阳性的猫可能携带其他疾病,婴儿、老年人和免疫抑制者可能希望避免接触。
症状
受感染的动物可能会出现贫血、淋巴瘤和其他疾病。FeLV-C亚型与红细胞表面血红素转运蛋白结合并阻碍其功能。结果是红细胞数量减少(贫血)。13 14 猫贫血的症状包括皮肤、舌头、牙龈和眼周粘膜的苍白。FeLV诱发的淋巴癌是猫最常见的肿瘤之一。症状取决于肿瘤的位置,可能包括体重减轻、毛发粗糙、食欲减退、呕吐、腹泻、呼吸窘迫、淋巴结肿大等等。FeLV还与肾脏、关节、淋巴结、小肠、肝脏和神经系统疾病有关。免疫系统的衰退使受感染的猫更容易受到感染。因此,它们可能被健康猫通常抵御的生物体感染。FeLV阳性的猫有可能保持健康。然而,猫持续性活性感染的预后较差。11
FeLV的检测
兽医使用几种不同的测试来检测FeLV。其中包括1)抗原酶联免疫吸附试验(ELISA)和2)间接免疫荧光抗体试验(IFA)。这两种测试都使用血液样本来测试是否存在表明FeLV感染的蛋白质。这种蛋白质叫P27,是病毒结构的一部分。11 没有结果的话可能需要其他方式来额外测试,例如一种特定类型的聚合酶链反应(PCR),它可以检测感染动物的FELVDNA。
FeLV感染的治疗
目前还没有治愈FeLV的方法。然而,根据兽医和专家的建议,宠物主任可以做一些事情来管理FeLV阳性猫:
- 每6个月去看一次兽医,做一次身体检查,完成血球计数,尿液分析和其他检查
- 仔细监控猫的健康状况(即测量并记录体重减轻情况)
- 为猫提供健康和均衡的饮食。避免未煮熟的肉和鸡蛋,以及未经高温杀菌的乳制品,以防止食物传播的感染。
- 把猫关在室内环境以减少接触有害生物。
抗病毒治疗已经用于FeLV阳性的猫,但是这些药物的有效性是有限的,而且它们可能是有毒的。控制和恢复免疫系统的药物(免疫调节剂)也被使用。然而支持这些药物的健康益处的数据是有限的。15 16
FeLV感染的预防
通过接种疫苗可以预防FeLV的感染。该疫苗被归类为非核心,这就意味着它可以被视为可选的。然而,美国猫科医师协会(AAFP)和欧洲猫科疾病咨询委员会(ABCD)的建议,所有FeLV状态不确定和或/有暴露风险的猫都应接种疫苗。小猫通常在8-9周龄时接种疫苗,12周龄时再接种一次。研究表明,这种疫苗可以提供长达一年的免疫力。许多兽医建议再初次接种疫苗一年和此后每年进行一次强化疫苗接种。因为猫随着年龄的增长变得不那么敏感,一些兽医认为每2-3年接种一次疫苗就足够了。11
访问一下不分了解更多信息:
猫鳞状细胞癌
介绍
鳞状细胞癌(SCC)是一种发生在猫和狗身上的癌症。这种肿瘤可以出现在许多地方,但最常见的是眼睛、耳朵、鼻子、口腔和几乎没有毛发的区域。
风险因素/检测/分期
皮肤鳞状细胞癌的主要原因是阳光过度暴露,这对白毛猫尤其有害。年龄和暴露于香烟烟雾也会增加SCC的风险。17
刚开始来说,SCC肿瘤看起来就像其他的皮肤过敏,让皮肤上的鳞状细胞癌很难被识别。结痂、脱发、皮肤受刺激、牙齿脱落、皮肤上隆起的红色肿块都可能是鳞状细胞癌的征兆。18
硬皮疮可以出现,并发展成神溃疡,当受到刺激时会出血。在晚期,癌症可能扩散到淋巴结和肺部。癌症的分期可能包括胸部X光片和检测淋巴液。19
在晚期病例中,鳞状细胞癌可导致组织死亡,破坏骨结构,导致疼痛,不适,甚至可能死亡。
治疗
对于鳞状细胞癌有几种治疗方法,它们可以结合起来以提高成功率。与其他癌症一样,发现鳞状细胞癌越早,治疗成功的可能性就越大。下颚或上耳的肿瘤可以通过手术切除。兽医试图尽可能多地保存健康组织。对于下颌骨的肿瘤,兽医可以进行外科下颌骨切除术,试图切除癌症区域。起初的颌骨组织和骨的数量取决于肿瘤。可能的副作用包括进食和梳洗困难,流口水和食欲减退。18
尽管有38%的癌症复发率和术后并发症,一项调查显示超过80%的猫主人会再次选择这种治疗。18
单纯的化疗并没被证明是有效的,但有证据表明,当与其他疗法结合时,它可能是有效的。化疗药物米托蒽醌联合外照射治疗的疗效优于单独使用的两种治疗方案。20
如果肿瘤在口腔内,应慎重考虑放射线,因为它会引起严重的炎症。副作用可能会妨碍正常进食,需要使用喂食管子。
冷冻治疗或冷冻手术包括插入一个探针,冷冻肿瘤,杀死癌细胞。冷冻疗法是直径小于1厘米(约0.4英寸)的肿瘤的一种选择。对于较大的肿瘤,复发率很高。21 冷冻疗法对于上耳肿瘤是一个很好的选择,因为这个位置允许直接和积极的治疗。
光动力疗法是一种较新的治疗鳞状细胞癌的方法。这种疗法并不是到处都有。它包括在肿瘤暴露在特定波长的光下,这会使感光化学物质变得活跃,破坏肿瘤细胞。22 它可以与其他治疗选择重复使用。23 副作用包括肿胀、发红、对光敏感以及肿瘤周围健康组织的死亡。最近的一项研究对12只患有鳞状细胞癌的猫进行了跟踪研究。研究人员发现,单独使用铂会导致鼻子和耳朵的浅部肿瘤缩小,但对比较深的肿瘤几乎没有影响,当于手术结合使用时,两只猫对治疗表现出部分反应,另一只表现出完全反应。22
猫乳腺癌

介绍
猫乳腺癌(FMC)是猫科动物中最常见的癌症,在雄性猫科动物中并不常见,但已有病例报道。24
由FMC引起的乳腺肿瘤可以是良性的也可以是恶性的,但是研究表明80%-96%的乳腺癌是恶性的,这意味着它们可以侵犯附近的组织,并且有转移的能力(扩散到身体的远处)。24
25
不幸的是,恶性乳腺癌肿瘤往往危害更大。
猫身体两侧各有四个乳腺,其中任何一个都可能受到FMC的影响。它们可能被称为腋腺、胸腺、腹腺和腹股沟腺。这些腺体是原发肿瘤生长的部位。与女性乳腺癌一样,FMC具有高度的转移性。因此,这种类型的癌细胞可以扩散到肺部,胸腔(胸膜)、肝脏、区域淋巴结和身体其他部位里。
人类乳腺癌研究中的靶向基因也在猫乳腺癌中进行了研究。HER-2/neu是编码人类表皮生长因子受体(2型)蛋白的基因。这种蛋白质存在于细胞表面,如果基因扩散产生HER-2基因的额外拷贝,那么其相应的蛋白质也会过度表现。这被认为会导致细胞增殖的增加。HER-2的过度表现在高达30%的人类乳腺癌病例中被检测到。24 同样,30%的猫乳腺病例也会发生这样的情况。4
风险因素/检测/分期
虽然所有的猫品种都可能受到口蹄疫的影响,但有些品种的风险高于其他品种。4
研究表明暹罗犬患这种癌症的风险是其他品种的两倍。24
26
发病风险随年龄增加而增加,肿瘤发生的平均年龄在10至11岁之间。24
27
早期的阉割可以降低风险,根据一项研究,完整的雌性猫患乳腺肿瘤的几率是被阉割幼年猫的7倍。28
最新有效降低FMC风险的年龄尚未确定。
FMC通常是在宠物主人或兽医在检查乳房区域时感到肿块时发现的,但肿块也可能表明其他情况,如严重炎症病变、囊肿、滤泡性肿瘤等。4 组织学可以用来确认诊断和对病变进行分类。根据组织/细胞在显微镜下的外观,将肿瘤分为高分化,中分化或者低分化。
兽医和研究人员一致认为肿瘤大小是FMC病例中最重要的预后因素,影响疾病的进展和生存时间。4 一般来说,较大的肿瘤预后较差,淋巴结受累程度和转移程度也决定了FMC的严重程度。
治疗
手术切除乳腺肿瘤是最常见的治疗方法,包括结节切除术(切除一个或多个细胞团),部分或完全接触受累乳腺,切除淋巴结,以及乳房切除术(切除患侧的所有腺体)。兽医除了手术外还可以使用放疗或放疗。用于治疗FMC的药物包括5-氟尿嘧啶、阿霉素、环磷酰胺、甲氨蝶咛、强的松和长春新碱。29
有研究表明,猫对阿霉素环磷酰胺治疗有反应,存活时间更长。30
访问以下部分了解更多信息:
狗的癌症

狗得各种各样的癌症。最常见的是皮肤癌,其他常见的犬类癌症包括乳腺癌、骨癌和白血病。在狗身上发现的其他类型的癌症包括口腔癌、淋巴瘤、睾丸癌、乳腺癌和腹部肿瘤。31 骨肉瘤,或骨癌,在常见的大型犬种中常见,比如大丹犬。藏獒,拉布拉多寻回犬和罗威犬。 3 31 狗的癌症通常于人类的癌症非常相似。犬类癌症的遗传风险于人类疾病相同。32
犬类传染性性病肿瘤
概述以及传播
人类的癌症实际上从来不会从一个人传染给另一个人。只有极少数有记载的例外情况存在,通常涉及到手术事故。斯蒂克肉瘤或犬传染性性病肿瘤(CTVT)是一种非常不寻常的癌症形式,影响犬类。CTVT通过交配、舔食或者其他直接接触的方式传播。33 肿瘤影响生殖器。在某些情况下,尿道阻塞,使受影响的动物很难排尿。34 下图(左)为CTVT肿瘤,呈典型的“菜花状”丘状。下图(右)为CTVT癌细胞的显微镜观察图。如果肿瘤位于口腔和鼻子,则流鼻血,面部肿胀和鼻孔分泌物是常见症状。
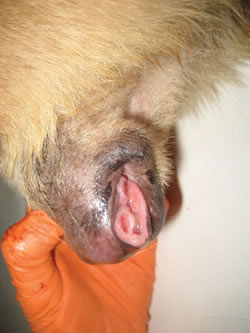
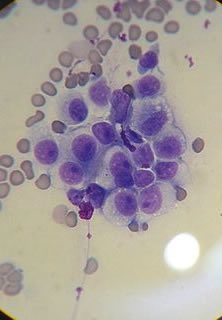
许多人类癌症是由病毒引起的,包括人类乳头状瘤病毒(HPV),它是宫颈癌的主要病因。感染病毒会导致受感染体内正常细胞的变化,并导致癌症的发展。CTVT与众不同!在这种情况下,癌细胞本身在动物之间传播。一旦进入新的动物体内,肿瘤就会生长并最终扩散到其他动物身上。35 实验表明CTVT不能通过杀死的肿瘤细胞或细胞物传播。33 病毒通常存在于细胞内的液体中;如果液体中的内容物不转移CTVT,则表明病毒对癌症没有责任。而且,迄今为止所有被检查的肿瘤细胞的DNA中都有一个正常细胞所没有的分子“指纹”。具体地说,癌细胞含有一个名为Line-1的DNA序列,插入癌基因c-myc附近。36
研究人员比较了不同品种狗的肿瘤DNA和正常DNA。结果显示了正常细胞DNA之间的预期差异,但是所有肿瘤DNA样本都非常的相似,尽管它们来自不同的狗。这些结果表明肿瘤细胞本身在动物之间传递CTVT。35
在大多数情况下,免疫系统会识别并清除动物(或者人类)的其他类型的细胞。CTVT不会发生这种情况。在最初的感染,CTVT开始一个快速和强烈的增长状态,持续三到九个月,在年老或虚弱的狗身上可能会长。33 这之后通常就会是一个变量回归阶段。
治疗CTVT
CTVT治疗选择包括手术,化疗或放射治疗。化疗通常非常有效,通常会导致完全缓解。手术的成功率并不高。37 因为癌症是在动物之间和几代人之间传播的,癌症本身被认为是非常老的!CTVT被认为是200-2500岁之间,代表了哺乳动物体内不间断复制的细胞。除了驯养的狗,它还可以传播给土狼,狐狸,狼,和免疫抑制的老虎。33 38
CTVT不能传染给人类!
犬骨肉瘤
介绍
骨肉瘤(OSA)是一种在骨骼内发展的癌症,通常是侵袭性和转移性的。39 OSA在小型驯养动物中相对罕见,仅占恶性肿瘤的5-6%。40 然而,它是迄今为止狗中最常见的原发性骨肿瘤,占病例的80%。40 41
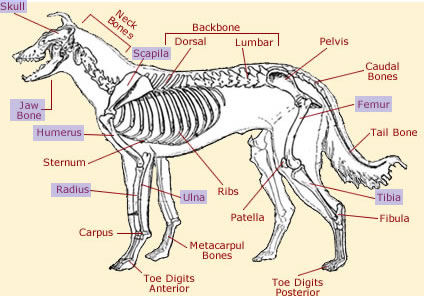
上图显示了一些受犬骨肉瘤影响的骨骼。这种类型的癌症最常见于阑尾骨骼。包括栲骨、尺骨、股骨、胫骨、肩胂骨、肱骨、和爪骨(指骨)。前肢比后肢更容易受到影响。OSA也发生在轴向骨骼中,包括脊柱,颅骨、颌骨(下颌骨),和脊柱底部的棰骨(骶骨)。在极少数情况下,它会影响骨骼外组织,如肌肉。40 41 由于其转移能力,OSA可以扩散到身体的其他部位。研究表明,OSA在大约17%的病例中会侵入肺部。41
风险因素/检测/分期
骨肉瘤在成年犬中更常见。体重44至88磅(20至40公斤)的大型动物比小型动物具有更高的风险。41
狗的OSA的征象包括由于疼痛和僵硬导致的运动受损。受影响的狗经常跛行以避免加重受肿瘤折磨的骨骼。它们还标显示出异常的骨骼生长和肿胀。
大肿瘤的规模与预后不良有关。42 肿瘤的位置也可以影响疾病的结果。轴向骨骼OSA和阑尾OSA倾向于拥有相似的预后。43 肱骨中的肿瘤往往预后不良,儿肱骨中的肿瘤往往具有更好的结果。42 43
治疗
肢体截肢是四肢OSA肿瘤的标准治疗方法。吗啡等镇痛药可用于缓解疼痛,大多数狗可在手术后12-24小时内行走。许多狗能够在一个月内适应截肢。有趣的是,研究表明,它们的的积极态度可以加速适应过程。44 手术后可能会发生的病状包括残端OSA的感染和复发。
某些情况可能使狗不适合截肢,包括关节炎,肥胖,神经系统问题和大型品种。因此,兽医将进行保肢手术,他们会移除肿瘤并使周围组织和骨骼保持完整。这种手术比截肢术句有更高的术后感染率和OSA复发率。研究表明,要求兽医进行保肢手术的最常见原因不是基于动物的状况。相反,主人不愿意继续截肢。45 46
兽医可以使用放射治疗来减轻疼痛,使动物更舒适。这种治疗可以减少炎症和治愈微骨折。研究表明,70%的狗对放射治疗有积极反应并经历疼痛缓解。40
也可以使用化疗药物如阿霉素,卡帕,顺怕或这些药物的组合。单独的化疗尚未显示延长存活时间。用手术和化疗治疗的受OSA影响的狗倾向于存活更长时间。47
不幸的是,尽管有可用的治疗选择,犬骨肉瘤的预后很差。无论使用哪种治疗,估计的存活时间从诊断时起为6至12个月。48 最常见的死亡原因(或安乐死)是疾病传播(或转移)。45
致谢: 上图是使用Creative Commons找到的,可以在此处访问。 它是在2009年8月10日获得并修改的。
犬血管肉瘤
介绍
血管肉瘤(HSA)是一种起源于血管细胞的癌症。HSA约占犬癌症病例的7%。事实上,它在狗中比任何其他被检查的动物更常见!49
HSA最常见于新长的脾脏,皮肤和右心房。50 原生性肿瘤也发生在肺,主动脉,肾,口腔,肌肉,骨,膀胱,前列腺,阴道,腹腔(腹膜),肠,舌和白色部分的膜中。51 52 HSA具有高度转移性,意味着它经常扩散。当HSA局限于皮肤时,它不太容易扩散。兽医估计,在诊断时,超过80%的其他病例已经转移。53 54
HSA细胞可以释放刺激新血管生长的蛋白质。这个过程被称为血管生成,对肿瘤的形成至关重要。众多血管的存在有助于为生长的肿瘤提供营养和氧气,并可作为癌细胞转移到身体远处的”高速公路“。
风险因素
年龄较大的动物发生血管肉瘤的风险较高。受影响的狗通常被诊断为9到12岁。55
比起比较小的动物,HSA更容易影响大品种动物。更容易得这种癌症的品种包括德国牧羊犬、金毛猎犬、拉布拉多猎犬、指示犬、拳师狗、英格兰赛特猎犬、大丹犬、猎犬和西伯利亚哈士奇。56
57
检测/症状
HSA的症状取决于癌症的位置和阶段,症状可能包括虚弱,体重减轻,心率增加(心动过速),呼吸异常快(呼吸急促),腹部肿胀,嗜睡和粘膜苍白。急性发作虚弱和/或崩溃可能表明肿瘤已经破裂,导致不受控制的失血。如果发生内出血并且血液从体腔重新吸收回血管,动物可能会逐渐恢复。在更严重的情况下,肿瘤破裂可能会导致猝死。58
兽医经常在体格检查时检测HSA。他们还是用血液检查,尿液分析,胸部x光检查,腹部超声检查,心脏超声检查(超声心动图),组织样本(活组织检查)等。一种名叫全血细胞计数(CBC)的血液检查可以检测贫血,畸形或碎片红细胞。一些检测甚至可以指示受该疾病影响的器官。显示未成熟红细胞(正常母细胞)数量增加的血液涂片可能表明脾脏癌。59 60
治疗
手术是HSA犬标准治疗的方法。在一项研究中,科罗拉多州立大学的研究人员尝试对76只HSA动物(66只狗和10只猫)进行手术。在42例中,外科医生能够完全切除肿瘤,没有可见的癌症。手术后,所有42只动物可以保持至少12个月的健康。其余34例动物经历了不完全的肿瘤切除和/或其他并发症;这些发现证实,完全切除肿瘤是这类癌症最重要的预后因素。研究人员还发现,某些肿瘤(即眼睛或皮肤)比其他肿瘤(即骨骼或肌肉)更容易切除。61
兽医可以使用其他方法治疗血管肉瘤,但其效果有限。除手术外可以使用化疗。研究表明,阿霉素是这类癌症最有效的化疗药物。尽管进行了治疗,但存活时间对于受HSA影响的狗通常不超过6个月。死亡通常是肿瘤转移到肺部和身体其他部位造成的。49
犬肥大细胞肿瘤
介绍
肥大细胞肿瘤,也称为肥大细胞瘤,是狗中最常见的皮肤癌。62
肥大细胞肿瘤最常见于7.5到9岁的狗,但偶尔也可见于4至6个月大的狗。63
不同品种的肥大细胞肿瘤发病率也不同。拳狮犬和波士顿梗犬发病率最高。63
肥大细胞肿瘤起源于肥大细胞,即在身体许多组织汇总发现的免疫系统细胞。64 由于肥大细胞几乎可以在任何地方发现,因此肥大细胞瘤有可能出现在身体的不同区域。它们最常见于后腿皮肤,颈部和腹部之间的区域(胸部)或生殖器区域。65 肥大细胞含有多种生物活性物质,包括组胺,肝素,血清素和前列腺素。这些化学物质在过敏反应过程中从细胞中释放出来。66 这些物质会引起与过敏相关的症状:发红,瘙痒,肿胀,血压下降,流泪,恶心,喘息等。通常这些化学物质受到高度调节,但当肥大细胞癌变时,它们不再适当控制释放的化学物质。
风险因素/检测/分期
肥大细胞瘤不受控制地释放化学物质会引起多种症状。任何特定的狗的症状都是可变的,但可能包括呕吐,溃疡血便排泄,腹痛和凝血困难;胃肠道物体是最常见的症状。67 肥大细胞瘤表现为凸起的肿块,外观经常受到刺激或呈红色。不幸的是,肥大细胞瘤没有特征性的形状或颜色,没有检测就无法辨别。62 通常当触摸肥大细胞瘤时,皮肤变得红色,发痒和肿胀。63 这种反应也被称为毛囊角化症的征兆。它的发生是因为当肿瘤的肥大细胞被压缩时,它们释放除化学组胺,这会引起皮肤刺激。
虽然正常的肥大细胞通常是相当稳定的,但晚期肥大细胞肿瘤可能会扩散(转移)到体内的其他部位。兽医使用六层系统(0至5期)对(阶段)肥大细胞肿瘤扩散的程度进行分类。62 分期考虑了肿瘤的数量和大小,淋巴结受累,和复发率。62 较高的阶段表示更大的身体受累,阶段5表示远处转移,包括骨髓或血液受累。63 另一种分类系统,组织学分级(1-3的值),基于肿瘤中细胞的物理外观。更多一场肥大细胞/组织与高的组织分级相关,并具有更高的恶性。63
治疗
手术切除肿瘤是中,下阶段肥大细胞瘤最常见的治疗方法。肿瘤周围约1英寸(2-3厘米)的健康组织也必须切除,以防止留下任何癌性肥大细胞。对于更晚期的阶段,仍建议手术,但通常结合放疗和化疗。63
如果手术不够彻底以去除所有细胞,则可以使用外部束放射也可以用于在手术前减小肿瘤的大小。63
如果您发现这些材料有用,请考虑参考我们的网站。
- 1Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11th ed.). Pearson.
- 2American Veterinary Medical Association. Material accessed: July 2009. [http://www.avma.org/careforanimals/animatedjourneys/pethealth/pethealth.asp]
- 3 a b c "Cancer Prevalent in Pets but Treatable, Says Veterinarian". Kansas State University. [http://www.newswise.com/articles/view/626941/?sc=dwhn]
- 4 a b c d e Zappulli V, De Zan G, Cardazzo B, Bargelloni L, Castagnaro M. Feline mammary tumors in comparative oncology. 2005 Journal of Dairy Research 72 98-106. [http://journals.cambridge.org/action/displayAbstract?fromPage=online&aid=330933&fulltextType=RA&fileId=S0022029905001263]
- 5National Pet Wellness (2009) How six-month wellness exams can help your pet live a longer, healthier life. [http://www.npwm.com/abt_campaign.htm]
- 6Bertone ER, Snyder LA, Moore AS 2002 Environmental Tobacco Smoke and Risk of Malignant Lymphoma in Pet Cats. American Journal of Epidemiology 156 268-273. [http://aje.oxfordjournals.org/cgi/content/abstract/156/3/268]
- 7 a b OConnor Jr TP, Tonelli QJ, Scarlett JM (1991) Report of the National FeLV/FIV Awareness Project. Journal of the American Veterinary Medical Association 199, 1348-1353. [PUBMED]
- 8Levy JK, Scott HM, Lachtara JL, Crawford PC (2006b) Seroprevalence of feline leukemia virus and feline immunodeficiency virus among cats in North America and risk factors for seropositivity. Journal of the American Veterinary Medical Association 228, 371-376. [PUBMED]
- 9Hardy WD Jr, Hess PW, MacEwen EG, et al. Biology of feline leukemia virus in the natural environment. Cancer Res 1976; 36: 582-588. [PUBMED]
- 10Pacitti AM, Jarret O, Hay D. Transmission of feline leukemia virus in the milk of a nonviraemic cat. Vet Rec 1986; 118: 381-384. [PUBMED]
- 11 a b c d Lutz, H et al (2009) FELINE LEUKEMIA: ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery 11, 565-574. [PUBMED]
- 12Terry A, Kilbey A, Naseer A, et al. Barriers to Infection of Human Cells by Feline Leukemia Virus: Insights into Resistance to Zoonosis. J Virol. 2017;91(5):e02119-16. Published 2017 Feb 14. doi:10.1128/JVI.02119-16 [PubMed]
- 13Riedel N, Hoover EA et al (1988), Pathogenic and host range determinants of the feline aplastic anemia retrovirus. Proc. Natl. Acad. Sci. 85: 2758-2762. [PUBMED]
- 14Weiss RA, Tailor CS (1995), Retrovirus Receptors. Cell 62: 531-533. [http://www.cell.com/issue?pii=S0092-8674(00)X0394-7]
- 15Levy J, Crawford C et al (2008), 2008 American Association of Feline Practitioners feline retrovirus management and guidelines. Journal of Feline Medicine and Surgery 10: 300-316. [PUBMED]
- 16Cornell University College of Veterinary Medicine (Accessed July 2009) Feline Leukemia Virus [http://www.vet.cornell.edu/fhc/brochures/felv.html]
- 17Marretta, J.J., Garrett, L.D., Marretta, S.M. Feline oral squamous cell carcinoma: an overview. Veterinary Medicine, June 2007; p392-406. [http://veterinarymedicine.dvm360.com/vetmed/article/articleDetail.jsp?id=433715]
- 18 a b c Marretta, J.J., Garrett, L.D., Marretta, S.M. Feline oral squamous cell carcinoma: an overview. Veterinary Medicine, June 2007; p392-406. [http://veterinarymedicine.dvm360.com/vetmed/article/articleDetail.jsp?id=433715]
- 19"Squamous Cell Carcinoma." Long Beach Animal Hospital. Accessed 2 June 2010 [http://www.lbah.com/feline/scc.html#intro]
- 20Ogilvie GK, Moore AS, Obradovich JE, Elmslie RE, al et. Toxicoses and efficacy associated with the administration of mitoxantrone to cats with malignant tumors. J Am Vet Med Assoc, 202: 1839-1844, 1993. [PUBMED]
- 21Ogilvie, Gregory K. "Ten Best Kept Secrets for Treating Cats with Cancer." Proc. of 27 World Small Animal Veterinary Association Congress, Spain, Granada. 2 June 2010 [http://www.vin.com/proceedings/Proceedings.plx?CID=WSAVA2002&PID=2636]
- 22 a b Ferreira, I., S. Rahal, N. Rocha, A.H. Gouveia, T., Y.K. Carvalho, V. Bagnato, Hematoporphyrin-based photodynamic therapy for cutaneous squamous cell carcinoma in cats. Veterinary Dermatology 20(2): 174-178, 2007. [PUBMED]
- 23De Vos, J. P., A.G.O. Burm, B.P. Focker, and De Ottenhorst. "Results from the treatment of advanced stage squamous cell carcinoma of the nasal planum in cats, using a combination of intralesional carboplatin and superficial radiotherapy: a pilot study." Veterinary and Comparative Oncology 2 (2004): 75-81. Wiley InterScience. 17 Aug. 2004. John Wiley & Sons, Inc. 15 July 2009. [http://www3.interscience.wiley.com/journal/118814840/abstract]
- 24 a b c d e Hayes HM Jr, Milne KL, Mandell CP. Epidemiological features of feline mammary carcinoma. Vet Rec. 1981;108(22):476–479. doi:10.1136/vr.108.22.476 [PUBMED]
- 25Misdorp W, Romijn A and Hart AA 1991 Feline mammary tumors: a case-control study of hormonal factors. Anticancer Research 11 1793-1797.Misdorp W, Romijn A, Hart AA. Feline mammary tumors: a case-control study of hormonal factors. Anticancer Res. 1991;11(5):1793–1797. [PUBMED]
- 26Ito T, Kadosawa T, Mochizuki M, Matsunaga S, Nishimura R, Sasaki N. Prognosis of malignant mammary tumor in 53 cats. J Vet Med Sci. 1996;58(8):723–726. doi:10.1292/jvms.58.723 [PUBMED]
- 27Misdorp W, Romijn A and Hart AA 1991 Feline mammary tumors: a case-control study of hormonal factors. Anticancer Research 11 1793-1797. [PUBMED]
- 28Weijer K, Hart AA. Prognostic factors in feline mammary carcinoma. J Natl Cancer Inst. 1983;70(4):709–716. [PUBMED]
- 29Stolwijk JA, Minke JM, Rutteman GR, Hoekstra J, Prop FJ, Misdorp W. Feline mammary carcinomas as a model for human breast cancer. II. Comparison of in vivo and in vitro adriamycin sensitivity. Anticancer Res. 1989;9(4):1045–1048. [PUBMED]
- 30Stolwijk JA, Minke JM, Rutteman GR, Hoekstra J, Prop FJ, Misdorp W. Feline mammary carcinomas as a model for human breast cancer. II. Comparison of in vivo and in vitro adriamycin sensitivity. Anticancer Res. 1989;9(4):1045–1048. [PUBMED]
- 31 a b Heather L. Gardner, Joelle M. Fenger and Cheryl A. London. Dogs as a Model for Cancer. 2016. Annu Rev Anim Biosci. 2016; 4: 199–222. Published online 2015 Nov 9. doi: 10.1146/annurev-animal-022114-110911 [ href=“https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6314649/“ target=“_blank”>PubMed]
- 32. (2020). Mutations of BRCA2 in canine mammary tumors and their targeting potential in clinical therapy. Bmc Veterinary Research, 16(1), 30. http://doi.org/10.1186/s12917-020-2247-4 (Original work published January 2020) [PUBMED]
- 33 a b c d Cohen, D. (1985). The canine transmissible venereal tumor: a unique result of tumor progression. Adv. Cancer Res. 43, 75112. [PUBMED]
- 34Hasler A, Weber W (2000). "Theriogenology question of the month. Transmissible venereal tumor (TVT)." J. Am. Vet. Med. Assoc. 216 (10): 15579. [PUBMED]
- 35 a b Murgia C, Pritchard JK, Kim SY, Fassati A, Weiss RA. "Clonal Origin and Evolution of a Transmissible Cancer". Cell (2006) 126(3):47787. doi:10.1016/j.cell.2006.05.051. [PUBMED]
- 36Katzir N, Rechavi G, Cohen JB, Unger T, Simoni F, Segal S, Cohen D, Givol D. "Retroposon" insertion into the cellular oncogene c-myc in canine transmissible venereal tumor. Proc. Natl. Acad. Sci. USA (1985) 82, 10541058. [PUBMED]
- 37Ettinger, Stephen J; Feldman, Edward C. (1995). Textbook of Veterinary Internal Medicine (4th ed.). W.B. Saunders Company. ISBN 0-7216-6795-3. [http://en.wikipedia.org/w/index.php?title=Special%3ABookSources&isbn=0721667953]
- 38Harmelin A, Pinthus JH, Katzir N, Kapon A, Volcani Y, Amariglio EN, Rehavi G. (2001). "Use of a murine xenograft model for canine transmissible venereal tumor." Am. J. Vet. Res. 62, 907911. [PUBMED]
- 39Thompson JP, Fugent MJ. Evaluation of survival times after limb amputation, with and without subsequent administration of cisplatin, for treatment of appendicular osteosarcoma in dogs: 30 cases (1979-1990). Journal of the American Veterinary Medical Association (1992) 200(4): 531-533. [PUBMED]
- 40 a b c d Endicott M. Principles of treatment for osteosarcoma. Clin Tech Small Anim Pract (2003) 12(2): 110-114 [PUBMED]
- 41 a b c d Cavalcanti JN, Amstalden EMI, Guerra JL, Magna LC. Osteosarcoma in dogs: clinical-morphological study and prognostic correlation. Brazilian Journal of Veterinary Research and Animal Science (2004) 41: 299-305. [http://www.scielo.br/scielo.php?pid=S1413-95962004000500002&script=sci_arttext]
- 42 a b Kuntz CA, Asselin TI, Dernell WS, et al. Limb salvage surgery for osteosarcoma of the proximal humerus: Outcome in 17 dogs. Vet Surg (1998) 27: 417-422. [PUBMED]
- 43 a b Straw AC, Powers BE, Kalusner J, et. al. Canine mandibular osteosarcoma: 51 cases (1980-1992). J Am Anim Hosp Assoc (1996) 32: 257-263. [PUBMED]
- 44Kirpensteijn J, van den Bos R, Endenburg N. Adaption of dogs to the amputation of a limb and their owners satisfaction with the procedure. Vet Rec(1999) 144: 115118. [PUBMED]
- 45 a b Dernell WS, Straw RC,Withrow SJ. Tumors of the skeletal system in Withrow SJ, MacEwen EG (eds): Small Animal Clinical Oncology (2001) pp 378-417. [http://books.google.com/books?id=wprLBe_0U5QC&pg=PA1&lpg=PA410&dq=(7)%09Dernell+WS,+Straw+RC,Withrow+SJ.+%E2%80%9CTumors+of+the+skeletal+system%E2%80%9D&source=bl&ots=r7lhpEbD4G&sig=gjm3XGCGvaZEgnqIldi_-4OJDDI&hl=en&ei=bpSBSqvzLOG_tgfw2KTSCg&sa=X&oi=book_result&ct=result&resnum=4#v=onepage&q=(7)%09Dernell%20WS%2C%20Straw%20RC%2CWithrow%20SJ.%20%E2%80%9CTumors%20of%20the%20skeletal%20system%E2%80%9D&f=false]
- 46Straw RC, Withrow SJ. Limb-sparing surgery versus amputation for dogs with bone tumors. Vet Clin North Am Small Anim Pract (1996) 26: 135143. [PUBMED]
- 47Liptak JM, et. al. Canine Appendicular Osteosarcoma: Curative-Intent Treatment. Compendium on Continuing Education for the Practicing Veterinarian (March 2004) pp. 186-197. [http://animalcancersurgeon.com/Review_Articles_files/Compendium%202004%20OSA%20II%20curative-intent.PDF]
- 48Thompson JP, Fugent MJ. Evaluation of survival times after limb amputation, with and without subsequent administration of cisplatin, for treatment of appendicular osteosarcoma in dogs: 30 cases (1979-1990). Journal of the American Veterinary Medical Association (1992) 200(4): 531-533. [PUBMED]
- 49 a b Helfand SC. Canine hemangiosarcoma: A tumor of contemporary interest. Cancer Therapy (2008) 6: 457-462.
- 50Pearson GR, Head KW. Malignant haemangioendothelioma (angiosarcoma) in the dog. Journal of Small Animal Practice (1976) 17: 737-745. [PUBMED]
- 51. (2017). Actionable mutations in canine hemangiosarcoma. Plos One, 12(11), e0188667. http://doi.org/10.1371/journal.pone.0188667 (Original work published December 2017) [PUBMED]
- 52. (2018). Canine sarcomas as a surrogate for the human disease. Pharmacology & Therapeutics, 188, 80-96. http://doi.org/10.1016/j.pharmthera.2018.01.012 (Original work published December 2018) [PUBMED]
- 53. (2017). Actionable mutations in canine hemangiosarcoma. Plos One, 12(11), e0188667. http://doi.org/10.1371/journal.pone.0188667 (Original work published December 2017) [PUBMED]
- 54. (2018). Canine sarcomas as a surrogate for the human disease. Pharmacology & Therapeutics, 188, 80-96. http://doi.org/10.1016/j.pharmthera.2018.01.012 (Original work published December 2018) [PUBMED]
- 55Bertazzolo W, et. al. Canine angiosarcoma: cytologic, histologic, and immunohistochemical correlations. Veterinary Clinical Pathology (2005) 34(1): 28-34. [PUBMED]
- 56Ward H, Fox LE, Calderwood-Mays MB, Hammer AS, Cuoto CG. Cutaneous hemangiosarcoma in 25 dogs: a retrospective study. J Vet Intern Med (1994) 8: 345-348. [PUBMED]
- 57Hargis AM, Ihrke PJ, Spangler WL, Stannard AA. A retrospective clinicopathologic study of 212 dogs with cutaneous hemangiomas and hemangiosarcomas. Vet Pathol (1992) 1992: 316-328. [PUBMED]
- 58. (2018). Canine sarcomas as a surrogate for the human disease. Pharmacology & Therapeutics, 188, 80-96. http://doi.org/10.1016/j.pharmthera.2018.01.012 (Original work published December 2018) [PUBMED]
- 59. (2017). Actionable mutations in canine hemangiosarcoma. Plos One, 12(11), e0188667. http://doi.org/10.1371/journal.pone.0188667 (Original work published December 2017) [PUBMED]
- 60. (2018). Canine sarcomas as a surrogate for the human disease. Pharmacology & Therapeutics, 188, 80-96. http://doi.org/10.1016/j.pharmthera.2018.01.012 (Original work published December 2018) [PUBMED]
- 61Schultheiss PC. A retrospective study of visceral and nonvisceral hemangiosarcoma and hemangiomas in domestic animals. J Vet Diagn Invest (2004) 16: 522-526. [PUBMED]
- 62 a b c d Nash, DVM, MS, Holly. "Canine Mast Cell Tumors: A Common Cancer in Dogs." Dog, Cat, and Pet Care Tips, Health and Behavior Information by Veterinarians. Veterinary Services Department. Web. 2 June 2010. [http://www.peteducation.com/article.cfm?c=2+1638&aid=461]
- 63 a b c d e f g Welle MM, Bley CR, Howard J, Rufenacht S. Canine mast cell tumours: a review of the pathogenesis, clinical features, pathology and treatment. Veterinary Dermatology (2008) 19(6): 321-39. http://www3.interscience.wiley.com/cgi-bin/fulltext/121451889/HTMLSTART [http://www3.interscience.wiley.com/cgi-bin/fulltext/121451889/HTMLSTART] [PUBMED]
- 64"Mast Cell." Encyclopædia Britannica. 2009. Encyclopædia Britannica Online. 2 June 2010 [http://www.britannica.com/EBchecked/topic/368641/mast-cell]
- 65"Cutaneous Mast Cell Tumors." The Merck Veterinary Manual. 2008. [http://www.merckvetmanual.com/mvm/index.jsp?cfile=htm/bc/72231.htm&word=canine%2cmast%2ccell]
- 66. (2019). Mast Cell Biology at Molecular Level: a Comprehensive Review. Clinical Reviews In Allergy & Immunology. http://doi.org/10.1007/s12016-019-08769-2 (Original work published December 2019) [PUBMED]
- 67Scott MA, Stockham SL: Basophils and mast cells. Schalm's Veterinary Hematology, 5th ed. Feldman BF, Zinkl JG, Jain NC (eds). Lippincott Williams & Wilkins, 2000, pp. 308-315.