癌症基因
細胞分裂是由一系列嚴密控制的流程來完成的。這些流程取決於一些基因的正常轉錄(transcription)與翻譯(translation)。如果這些流程出現異常,則可導致細胞生長的失控。現在認為,人類基因組大約有30,000個基因,其中少部分基因似乎在腫瘤的預防、發生與進展方面起著十分重要的作用。在許多不同類型的惡性腫瘤中,這些基因出現功能異常或功能喪失。
對於已鑑別出的基因,可根據它們在細胞中的正常功能,分為如下兩大類:
- 第一類基因是它們的蛋白質產物能刺激或提高細胞的分裂能力與生存能力。這一類基因還包括那些能抑制細胞死亡從而在腫瘤生長上起了一定作用的基因。
- 第二類基因是它們的蛋白質產物能直接或間接阻止細胞分裂或導致細胞死亡。
第一類基因的正常“版本”叫做原癌基因(proto-oncogenes)。然而,這類基因的“突變” 版本或“受損”版本則成了癌基因(oncogenes)。
第二類基因可叫做腫瘤抑制基因(tumor suppressors)。
請注意正文中與“基因”有關的名詞是否是“斜體”字型。按照慣例,若基因名詞為“斜體”,則表示“基因”本身;若不是“斜體”,則表示“該基因所產生的蛋白質”。例如,p53表示“基因”;而p53則表示“該基因所產生的蛋白質”。
Topics on this page:
癌基因
腫瘤抑制基因與癌基因對人體的作用可以用汽車來做比喻。原癌基因就如同下面動畫中的汽車油門,控制著汽車的運動。當汽車處於正常狀態時,只有踩下油門時汽車才能開動。在正常細胞中,細胞內、外的信號都能控制癌基因的活性。在下面動畫中,這些信號用"X"型的生長因子和踩油門的腳來表示。
有缺陷的癌基因就像是油門始終處於“開”的狀態,此時不再需要某種信號來激活這些基因,這輛汽車無論是踩或不踩油門都會向前行駛。
把這個比喻用於細胞:即使沒有信號指示細胞分裂,細胞仍會持續地分裂下去。我們的每個基因都有兩套,對於癌基因來說,只要其中一套基因有缺陷就會導致細胞的持續分裂。
目前已經有大量的基因被鑑定為原癌基因,其中有許多基因負責提供導致細胞分裂的陽性信號。一些原癌基因作用於調節細胞死亡。正如在本節介紹所述,癌基因(也就是這些基因的缺陷版本)可以導致細胞無管制的分裂。即使在沒有正常促生長信號,如生長因子的情況下,這種增長仍可以發生。癌基因活動的一個主要特點是一套缺陷版本就可以導致細胞生長失控。這與腫瘤抑制基因完全不同,腫瘤抑制基因必須需要兩套基因都有缺陷才會導致細胞異常分裂。
迄今,那些被確定的原癌基因在細胞中有許多不同的功能。儘管他們的正常功能有差異,這些基因的突變體形式(致癌版本)均導致無管制的細胞分裂。突變體蛋白通常情況下能保留一些自己原有的功能,但對正常形態下的該做出反應的管理信號不再敏感了。在下文中,我們選取了一些與許多癌症相關的癌基因,並加以詳細地描述。
HER-2/Neu
HER-2/neu(即erbB-2)是壹種能為人類表皮生長因子受體2型編碼的基因。在壹些正常細胞上會發現中等含量的這種受體。顧名思義,這種受體參與了細胞對生長因子的反應。如下圖所示,在適當條件下,這種基因與生長因子結合則可刺激細胞分裂。
在人類乳腺癌病例中,高達30%的病例具有HER-2/neu基因的擴增。HER-2/neu基因復制本數目的增加可導致細胞表面HER-2蛋白的表達增高,從而導致細胞增生速度加快(如下圖所示)。1目前認為,基因擴增會影響腫瘤生長與擴散的能力,也會影響腫瘤對治療的反應。該基因的過度表達可使腫瘤更具侵襲性,但也可使腫瘤對某些化療藥物更加敏感。 2關於基因擴增的更多信息
HER-2/Neu與癌症治療
HER-2/neu基因的過度表達對化療藥物有效性的影響尚未清楚。目前已開展了幾項研究,其目的是確定HER2蛋白對化療藥物有效性到底有什麼樣的影響。最近的一項研究是讓140例原發性乳腺腫瘤患者使用不同濃度的兩種化療藥物組合。研究結果顯示,HER-2/neu表達較強的細胞比表達較弱的細胞更易受到化療藥物的影響,腫瘤生長受抑的程度更為明顯。 HER-2/neu擴增似乎讓腫瘤細胞對化療藥物獲得敏感性,而不是讓它們形成耐藥性。化療藥物攻擊的是正在復制基因的細胞,HER-2/neu擴增導致複製速度加快。因此,可以得出這樣一個結論:由於細胞分裂速度加快,HER2過度表達的腫瘤細胞將被更有效的殺死。然而,由於出現了一些與之矛盾的結果(即對化療藥物不敏感),HER-2/neu擴增的真正作用尚未完全清楚。2
還有一些研究顯示,HER-2/neu的過度表達與雌激素受體陰性、腫瘤細胞分化低、病人存活率下降有關。3顯然,這種原癌基因在幾種惡性腫瘤的發生上起了重要作用,但是這方面的研究還遠遠沒有結束。
抗體治療與HER2
癌症治療一直是針對那些HER2蛋白過度表達的癌症細胞。 Genentech公司研製的曲妥單抗 (Herceptin®)是一種人源化單克隆抗體抗體,其能與HER2蛋白結合,阻斷其活性,從而阻止細胞的過度增生。下面的動畫顯示了這個過程。最近,Herceptin®和化療藥物的配合使用去治療HER-2/neu基因擴增的惡性腫瘤。3, 1 關於癌症的抗體治療的更多信息antibody treatments for cancer。
RAS
RAS基因的產物參與了控制激酶的信號傳導路徑,以及能控制基因轉錄,從而調節細胞的生長與分化。為了打“開”這條路徑,RAS蛋白必須與細胞內的三磷酸鳥苷(GTP)分子結合。為了“關”閉這條路徑,RAS蛋白必須裂解GTP分子。 RAS基因的改變可以使RAS蛋白髮生變化,從而使RAS蛋白不再具有裂解GTP分子和釋放GTP分子的能力。這樣的改變導致這條信號傳導路徑始終處於“開”通的狀態。4 這種“開”的信號導致細胞的生長和增生。因此ras的過度表達與擴增導致持續的細胞增殖,這是腫瘤發生的關鍵一步。5 細胞分裂由“正”與“負”信號的平衡來調控。當ras轉錄增加時,過多的基因蛋白積蓄在細胞內;此時,細胞分裂的“正”信號則強於“負”信號。
RAS基因的點突變通常導致RAS從原癌基因向癌基因的轉化。這樣的功能改變對細胞的影響是多方面的,因為RAS參與了許多控制細胞分裂與死亡的信號傳導路徑。目前研製的抗腫瘤藥物正是針對這樣的RAS依賴性路徑。然而,此類藥物要應用於臨床還得進行許多研究才能實現。6
突變的RAS基因在如下器官的惡性腫瘤中已得到鑑定: 胰腺(90%)、結腸(50%)、肺(30%)、甲狀腺(50%)、膀胱(6%)、卵巢(15%) 、乳腺、皮膚、肝臟、腎臟、某些類型的白血病。4 在將來,有可能使用ras來鑑定某些惡性腫瘤。胰腺腫瘤一直難於診斷,但是在隨糞便排出的胰腺細胞的DNA 裡,將RAS基因突變鑑定出來,則可幫助臨床醫師鑑別胰腺炎與胰腺癌。4
MYC
MYC蛋白是一種轉錄因子,它控制著幾種基因的表達。在許多不同的惡性腫瘤中都發現有MYC基因的突變,如伯基特淋巴瘤,B細胞白血病和肺癌。 MYC癌基因家族可通過基因重排(gene rearrangement)和基因擴增(amplification)被激活。基因重排涉及到染色體的斷裂與重排。這過程可波及到大量DNA,影響到多個基因。基因或基因群的移動可發生在一個染色體內,也可發生在不同染色體之間。這樣的移動常常導致基因表 的改變和細胞功能的改變。
染色體易位是一種基因重排,在8號與14號染色體之間的易位常導致MYC基因的過度表達,最終導致B細胞淋巴瘤。下面的動畫顯示了兩個不同染色體之間發生易位的情形。
MYC蛋白在細胞中的含量是十分重要的,因為MYC蛋白活性的平衡要靠另一種蛋白與MYC蛋白抗衡。因此,這兩種蛋白中的任何一種的含量增加都會破壞這種平衡,從而影響細胞分裂。7
在上面的視頻中,杰拉德·埃文博士討論了MYC蛋白在癌症中的作用。觀看完整的埃文博士採訪。 (Watch the full interview with Dr. Evan.)
MYC活性的增加有時會導致細胞的程序化死亡,但這種保護機制似乎會因另一種癌基因bcl-2的存在而遭到破壞,bcl-2可阻止myc所誘導的細胞凋亡(apoptosis )。7
SRC
SRC是最先發現的癌基因(oncogene)。SRC是在作為勞斯肉瘤病毒(RSV)的轉化試劑(致癌試劑)時被鑒定出來的。這種病毒可感染雞和其它動物。RSV是壹種逆轉錄病毒(retrovirus)。它能夠感染細胞,並能將自己的基因“插入”到這個細胞的DNA中,很快導致癌癥的發生。因此,這種病毒被稱作急性轉化病毒。當雞被感染後,常在兩周內出現大塊腫瘤。研究人員發現,來自於RSV中的某個基因的蛋白質可導致細胞以異常方式生長。在人類基因組也發現了相對應的原癌基因。這種人類基因,如果被激活為癌基因後,也會以相似的方式致癌。
SRC蛋白是壹種酪氨酸激酶。激酶(kinases)是壹種可將磷酸基轉移到靶分子上的酶。這個過程非常重要,因為去除或增添磷酸基可使生物分子發生改變,從而調節細胞的活動。磷酸基的增添或去除就像開關壹樣,調控著靶分子的活性。SRC蛋白可改變幾種靶分子,從而傳遞信號給細胞核,有助於細胞活動的調節。7
目前已發現至少9種SRC基因。由於這些基因所產生的mRNA進過不同的處理加工,所以生成了至少14種不同的蛋白質。在大多數細胞中會發現低含量的C-SRC。但是在某些類型的惡性腫瘤中,C-SRC會被過度表達,比如人類神經母細胞瘤、小細胞性肺癌、結腸癌、乳腺癌、橫紋肌肉瘤。4
端粒酶
由於DNA複製過程的特性,染色體的末端(稱作“端粒”)會在每次細胞分裂過程中變短。變短的染色體限制了細胞可進行分裂的次數。當端粒縮短到一定程度時,如果細胞繼續進行DNA複製,就會丟失重要的遺傳物質。此時,正常細胞會進入細胞衰老過程,或出現生長驟停。在這兩種情況下,細胞不再繼續分裂。
然而,癌細胞卻有能力繼續複製它們的DNA,不進入衰老期。在許多癌症中,這種無限制的細胞分裂能力是由於一種叫端粒酶的產生所致。這種酶能維護染色體的末端,從而防止它變短。端粒酶是一種存在於胎兒發育時期的正常蛋白質。然而在成人的大多數細胞中,這種酶已不再存在,因為這種酶的基因不再被表達(被轉錄和翻譯)。但是在某些癌細胞中,為這種酶編碼的基因被重新激活,最終導致複製失控。
以下動畫顯示了兩種染色體,右側是具有活性的端粒酶,左側是不具活性的端粒酶。
在癌细胞中,即使不存在端粒末端转移酶活性,染色体也不会缩短,这种现象可由其它机制解释。因为只有保持端粒的长度,才能使细胞分裂不受限制。hTERT是为端粒酶的活性成分编码的基因,被认为是原癌基因,因为它的异常表达可导致细胞生长失控。
BCL-2
BCL-2 (即B細胞淋巴瘤基因2)蛋白與細胞膜以及細胞膜的活性密切相關。 BCLl-2蛋白是調控細胞凋亡的複雜信號系統的一個組成部分。細胞凋亡可由多種信號誘導,包括DNA的不可修復性損傷。這種細胞以自殺的方式阻止了細胞損傷的進一步擴展。 Bcl-2可阻止細胞凋亡。 8 因此,其過度表達可阻止損傷細胞的凋亡,這樣就導致了突變細胞系的持續分裂,最終導致癌症的發生。此外,BCL-2的過度表達也可導致一些癌症的轉移。9
如果細胞凋亡的控制受到破壞,那麼誘導細胞凋亡的抗癌藥物就不會像以前那樣有效了。所以一些藥物正在被開發,作用於抑制BCL-2基因的表達,讓其它抗癌藥物更有效(而且劑量更少)。其中一種藥物是Genasense,其為一種反義核苷酸。這種藥物在一期實驗中可降低BCL-2蛋白的產生,目前正在進行二期和三期試驗,可作為多種惡性腫瘤治療的輔助性藥物。 10 關於反義藥物(antisense drugs)的更多信息。
此外,還有一些藥物是間接地減少BCL-2蛋白含量,比如全反式維甲酸、紫杉醇、長春新鹼、多西紫杉醇。這幾種藥物常與其它化療藥物聯合使用。還有一些新的藥物 (尚未進行人體實驗),比如“BCL-2結合多肽”能導致BCL-2蛋白失活、抗黴素A能與“Bcl-2相關蛋白”結合。11
既然BCL-2基因的過度表達會影響癌症治療的成功率,所以確定其功能是否正常則成為一種有價值的診斷依據。這種原癌基因可通過易位導致基因過度表達,繼而激活為癌基因。在許多不同的癌症中發現了高含量的BCL-2蛋白。12
EGFR
表皮生長因子受體(EGFR)是一種跨膜蛋白。它有一部分在細胞外,然後穿過細胞表面,伸出一部分到細胞質。它的功能是作為一種蜂窩天線。當特定的蛋白質與EGFR結合時,兩個表皮生長因子受體蛋白會彼此粘連。 EGFR的例子有:表皮生長因子或轉化生長因子α。結合的兩個蛋白質整體被稱為二聚體,而二聚體的形成會激活受體,從而導致自身磷酸化過程。這兩個蛋白質會互相添加一種小分子化學物質,叫做磷酸基團。 EGFR的激活可以提高細胞增殖和存活的活性。13
在許多癌症中,EGFR基因發生突變或過度活躍,這些癌症有乳腺癌,肺癌,食道癌,頭頸部癌。14 在癌細胞和在腫瘤中存在的其它細胞中,EGFR的過度活動會導致血管生長,過度細胞分裂,增強細胞存活和細胞運動,從而導致癌症的擴散。13
目前針對EGFR突變使用的靶向療法有:單克隆抗體和酪氨酸激酶抑製劑(TKI)。一些抗體,例如西妥昔單抗(Erbitux®)和帕尼單抗(Vectibix®),如果和EGFR的細胞外部分結合可以防止配體激活受體。而一些TKI,例如吉非替尼(Iressa®)和厄洛替尼(Tarceva®),如果和EGFR的細胞內部分結合可以防止激活過程。13
癌基因一覽表
| Oncogene | 功能/激活 | 癌症* | 參考文獻 |
| ABL | 通過酪氨酸激酶活性促進細胞生長 | 慢性粒細胞白血病 | 15, 16 |
| AF4/HRX |
融合影響HRX轉錄因子/甲基轉移酶。 HRX也稱為MLL,ALL1和HTRX1 |
急性白血病 | 17 |
| AKT-2 |
為絲氨酸/蘇氨酸蛋白激酶編碼 |
卵巢癌 | 17, 18 |
| ALK | 為酪氨酸激酶受體編碼 | 淋巴瘤 | 19 |
| ALK/NPM | 易位產生融合蛋白與核磷蛋白(npm) | 大細胞淋巴瘤 | 19 |
| AML1 | 為一種轉錄因子編碼 | 急性骨髓性白血病 | 17 |
| AML1/MTG8 | 通過易位產生的新融合蛋白 | 急性白血病 | 17 |
| AXL | 為酪氨酸激酶受體編碼 | 造血系統惡性疾病 | 17 |
| BCL-2, 3, 6 | 阻斷細胞凋亡 (程序化細胞死亡) | B- 細胞淋巴瘤、白血病 | 16, 17 |
| BCR/ABL | 通過bcr和abl的融合產生的新蛋白質引發不受調節的細胞生長 | 慢性髓細胞白血病、急性淋巴細胞白血病 | 15, 16 |
| c-MYC | 促進細胞增殖和DNA合成的轉錄因子 | 白血病、乳腺癌、胃癌、肺癌、宮頸癌、結腸癌、神經母細胞瘤、膠質母細胞瘤 | 20 |
| DBL | 鳥嘌呤核苷酸交換因子 | 瀰漫性B-細胞淋巴瘤 | 17 |
| DEK/CAN | 融合產生新蛋白 | 急性骨髓性白血病 | 17 |
| E2A/PBX1 | 融合產生新蛋白 | 急性體B細胞白血病 | 17 |
| EGFR | 通過酪氨酸激酶活性觸發細胞生長的細胞表面受體 | 鱗狀細胞癌 | 15, 16 |
| ENL/HRX | 通過易位t(11; 19)產生的融合蛋白 | 急性白血病 | 17 |
| ERG/TLS | 融合蛋白由t(16:21)易位產生,erg蛋白是轉錄因子 | 髓細胞白血病 | 16, 17 |
| ERBB |
通過酪氨酸激酶活性觸發細胞生長的細胞表面受體 |
膠質母細胞瘤、鱗狀細胞癌 | 15 |
| ERBB-2 | 通過酪氨酸激酶活性觸發細胞生長的細胞表面受體; 也稱為HER2或neu | 乳腺癌、唾液腺癌、卵巢癌 | 15, 18 |
| ETS-1 | 轉錄因子 | 淋巴瘤 | 21 |
| EWS/FLI-1 | 通過易位t(11:22)產生的融合蛋白 | Ewing肉瘤 | 16, 21 |
| FMS | 酪氨酸激酶 | 肉瘤 | 22 |
| FOS | API的轉錄因子 | 骨肉瘤 | 16, 5 |
| FPS | 酪氨酸激酶 | 肉瘤 | 22 |
| GLI | 轉錄因子 | 膠質母細胞瘤 | 23 |
| GSP | 膜相關的G蛋白 | 甲狀腺癌 | 5 |
| HER2/neu | 由於基因擴增導致傳導激酶的過度表達 | 乳腺癌、宮頸癌 | 15, 5 |
| HOX11 | 轉錄因子 | 急性 T- 細胞白血病 | 17 |
| HST | 編碼成纖維細胞生長因子 | 乳腺癌、鱗狀細胞癌 | 17 |
| IL-3 | 細胞信號分子 | 急性前體B- 細胞白血病 | 17 |
| INT-2 | 編碼成纖維細胞生長因子 | 乳腺癌、鱗狀細胞癌 | 17 |
| JUN | API的轉錄因子 | 肉瘤 | 18, 5 |
| KIT | 酪氨酸激酶 | 肉瘤 | 18, 5 |
| KS3 | 皰疹病毒編碼的生長因子 | 卡珀斯氏肉瘤 | 5 |
| K-SAM | 成纖維細胞生長因子受體 | 胃癌 | 17 |
| LBC | 鳥嘌呤核苷酸交換因子 | 髓細胞白血病 | 5, 24 |
| LCK | 酪氨酸激酶 | T- 細胞淋巴瘤 | 5 |
| LMO1, LMO2 | 轉錄因子 | T- 細胞淋巴瘤 | 5 |
| L-MYC | 轉錄因子 | 肺癌 | 17, 18 |
| LYL-1 | 轉錄因子 | 急性 T- 細胞白血病 | 17 |
| LYT-10 | 轉錄因子。也稱為NF κB2 | B- 細胞淋巴瘤 | 5 |
| LYT-10/Cα1 | 通過(10; 14)(q24; q32)lyt-10移位緊鄰Cα1免疫球蛋白基因座產生的融合蛋白 | 17 | |
| MAS | 血管緊張素受體 | 乳腺癌 | 5 |
| MDM-2 | 為一種能抑制並降解p53的蛋白質編碼 | 肉瘤 | 17, 18 |
| MLL | 轉錄因子/甲基轉移酶(也稱為hrx和ALL1) | 急性骨髓性白血病 | 16, 5 |
| MOS | 絲氨酸/蘇氨酸激酶 | 肺癌 | 17, 25 |
| MTG8/AML1 | 轉錄抑制因子與轉錄因子的融合。 AML1也稱為RUNX1。 | 急性白血病 | 17 |
| MYB | 轉錄因子 | 結腸癌、白血病 | 17 |
| MYH11/CBFB | 通過轉錄因子融合產生新蛋白質(通過染色體16上的倒位) | 急性骨髓性白血病 | 17 |
| NEU | 酪氨酸激酶。也稱為erbB-2或HER2 | 膠質母細胞瘤和鱗狀細胞癌 | 15, 17 |
| N-MYC | 細胞增殖和DNA合成 | 神經母細胞瘤、 視網膜母細胞瘤、肺癌 | 15, 17 |
| OST | 鳥嘌呤核苷酸交換因子 | 骨肉瘤 | 5 |
| PAX-5 | 轉錄因子 | 淋巴漿細胞樣B-細胞淋巴瘤 | 5 |
| PBX1/E2A | 通過t(1:19)易位形成融合蛋白。轉錄因子 | 急性前體B-細胞白血病 | 17 |
| PIM-1 | 氨酸/蘇氨酸激酶 | T- 細胞淋巴瘤 | 5 |
| PRAD-1 | 為細胞週期蛋白D1編碼,參與細胞週期調節。 | 乳腺癌、鱗狀細胞癌 | 17 |
| RAF | 絲氨酸/蘇氨酸激酶 | 多種癌症類型 | 17 |
| RAR/PML | 通過t(15:17)易位形成融合蛋白。視黃酸受體。 | 急性早幼粒細胞白血病 | 15, 17 |
| RAS-H | G蛋白,信號轉導。 | 膀胱癌 | 17 |
| RAS-K | G蛋白,信號轉導。 | 肺癌、卵巢癌、膀胱癌 | 17, 18 |
| RAS-N | G蛋白,信號轉導。 | 乳腺癌 | 17 |
| REL/NRG | 2號染色體缺失形成的融合蛋白。轉錄因子 | B- 細胞淋巴瘤 | 17, 18 |
| RET | 細胞表面受體。酪氨酸激酶 | 甲狀腺癌、多發性內分泌瘤2型 | 15, 17 |
| RHOM1, RHOM2 | 轉錄因子 | 急性 T- 細胞白血病 | 17 |
| ROS | 酪氨酸激酶 | 肉瘤 | 5 |
| SKI | 轉錄因子 | 癌 | 5 |
| SIS | 生長因子 | 神經膠質瘤、纖維肉瘤 | 5 |
| SET/CAN | 通過9號染色體重排形成的融合蛋白。蛋白定位 | 急性骨髓性白血病 | 5, 26 |
| SRC | 酪氨酸激酶 | 肉瘤 | 17, 27 |
| TAL1, TAL2 | 轉錄因子。 TAL1也稱為SCL | 急性 T- 細胞白血病 | 17, 28 |
| TAN-1 | 通過t(7:9)易位形成Notch細胞受體的改變形式 | 急性 T- 細胞白血病 | 17, 29 |
| TIAM1 | 鳥嘌呤核苷酸交換因子 | T- 細胞淋巴瘤 | 5, 30 |
| TSC2 | GTP酶激活劑 | 腎癌、腦瘤 | 5, 31 |
| TRK | 受體酪氨酸激酶 | 結腸癌、甲狀腺癌 | 17, 32 |
*以上表格列出的癌症類型是與每個癌基因相關的主要癌症類型,但這不是詳盡的列表。
了解更多相關信息,請訪問癌症基因組解剖項目Cancer Genome Anatomy Project。
本節小結:癌基因
癌基因
- 癌基因是正常細胞基因(原癌基因)的突變形式。
- 原癌基因的蛋白產物可以刺激細胞分裂和/或抑制細胞死亡。
- 原癌基因可以比喻為一輛汽車的油門踏板。
- 通常情況下,內部和外部信號嚴格控制原癌基因的活性,但是癌基因有缺陷,所以當他們沒有收到適當的信號時,也會處於“開”的模式。
- 癌基因也幫助細胞忽視那些防止健康細胞分裂的負信號。
- 致癌基因可導致細胞持續分裂,即使沒有接收到任何促生長信號。
- 以下列舉了一些已知致癌基因的不同的細胞作用:
- HER-2/neu
- HER-2/neu 給一種細胞表面受體編碼,能刺激細胞分裂。
- HER-2/neu基因在人類乳腺癌中可以給擴增高達30%。
- RAS
- Ras的基因產物參與激酶信號傳導途徑,最終控制基因的轉錄,調節細胞生長和分化。
- RAS的過度表達和擴增可導致持續的細胞增殖。
- MYC
- Myc蛋白是一種轉錄因子,它能控制一些基因的表達。
- Myc被證實會參與避免細胞死亡機制。
- MYC致癌基因可能會被基因重排或擴增激活。
- SRC
- SRC是迄今第一個被發現的基因。
- Src蛋白是一種能調節細胞活性的酪氨酸激酶。
- hTERT
- hTERT 編碼一種能維持染色體末端的酶,叫做端粒酶。
- 在大多數正常細胞中,端粒酶只有在胎兒發育過程中才存在。
- 在成年細胞中,hTERT的激活會給他們無限分裂的能力。
- hTERT 編碼一種能維持染色體末端的酶,叫做端粒酶。
- BCL-2
- Bcl-2蛋白作用於防止細胞死亡(細胞凋亡)。
- BCL-2的過度表達會導致突變細胞的持續分裂。
- HER-2/neu
了解流程:癌基因
“了解流程”是一個測試您知識的教育遊戲。開始遊戲:
- 從右邊欄選擇適當的選項,並將它們拖入左邊相對應的方框中。請注意,您將只使用六個選項中其中五個來完成遊戲。
- 完成後,請點擊“查詢”來查看您的正確率。
- 對於不正確的答案,可單擊“說明”來複習相關信息。
- 如果想要再試一次,請選擇“重置”並重新開始遊戲。
Please visit us on a larger screen to play this game.
下圖列出了上述一些癌基因的功能。其他許多癌基因都具有這些相似的活動。

腫瘤抑制因子
腫瘤抑制基因作用於許多關鍵的細胞活動過程,如轉錄、DNA修復、細胞與細胞之間的信息交流。這些基因的功能喪失將會導致細胞行為方式的異常。
繼續之前的那個比喻,腫瘤抑制基因就像是汽車的剎車系統。如果妳認為腫瘤抑制基因的每個副本都對細胞的“剎車”起作用,那麽這個比喻具有壹定的說服力。當兩套腫瘤抑制基因的副本都起作用時(在下圖中用突出顯示的基因和停止標誌表示),細胞就會停止分裂(像汽車就會停止行駛壹樣)。
當腫瘤抑制基因的壹套副本出現缺陷,細胞還有另壹套副本在起作用。就像汽車停車只使用了前剎或後剎,而不是同時使用了前剎和後剎。盡管停車效果沒有那麽好,但仍然能停下來。所以,當細胞有壹套發生缺陷的腫瘤抑制基因副本時,細胞仍能控制它的細胞分裂。但如果另壹套腫瘤抑制基因副本也不起作用時,細胞就會失去對細胞分裂的控制。
在下面章節中,我們將介紹視網膜母細胞瘤(retinoblastoma, Rb)的腫瘤抑制基因,這將是壹個闡明這個機制的好例子。
所有癌癥都顯示出壹個或多個腫瘤抑制基因和癌基因的改變。在正常細胞中,這兩者生成的蛋白質共同控制著細胞分裂,而在癌細胞中,這樣的控制則出現異常。
由於這些基因在癌癥發生上是十分重要的,在以下章節中將詳細介紹壹些特異性腫瘤抑制基因、以及與之有關的癌癥。參與這些過程的基因幾乎每天都在增加,但這裏只能介紹部分至今了解得比較多的基因,從中可以理解癌癥是如何導致壹下細胞功能的失調。
p53簡介
p53 (或TP53)基因在1979年被發現,是迄今為止與癌症相關性最強的基因之一。該基因位於17號染色體,其蛋白產物具有轉錄因子的功能。 p53蛋白所控制的基因參與細胞分裂與生存能力。與其它腫瘤抑制基因一樣,p53蛋白作用於阻止細胞生長的失控。
p53蛋白與DNA有直接的相互作用,與其它支配細胞行為方式的蛋白也有相互作用。當發現DNA受損或其它細胞受損時,p53立即啟動細胞死亡(即細胞凋亡)機制。 p53蛋白在維持細胞正常調控方面起著關鍵性作用,尤其體現在大約半數的腫瘤中,不論其類型或起源如何,都會發現存在著p53基因的缺陷。7, 33 在一個人的一生中,都可能出現使p53基因活性消失的突變(散發性突變)或是通過遺傳獲得這類型突變。
p53基因的發現
在1979 年,科學家們發現了一種新的蛋白質。這種蛋白質能與猿猴病毒40( SV40)中的一種轉化蛋白-大型T抗原結合。與正常細胞相比,這種蛋白質在病毒轉化的細胞(具致永生和致癌性)裡更為常見。該蛋白質和其相應基因被命名為p53,這是根據該蛋白質的質量是53千道爾頓來命名的。 p53基因位於17 號染色體p13位置上。34
雖然p53是繼Rb之後發現的第二個腫瘤抑制因子,但是科學家們直到p53發現後10年才了解它在細胞裡的作用。35 因為p53在被轉化的細胞裡含量增高,所以科研人員最初認為它的作用類似癌基因。 40最初的研究結果也支持這種看法。科學家們發現,當p53基因進入細胞,細胞則發生轉化。但是科研人員後來發現,進入到細胞裡的p53基因實際上是這種基因的突變型,因為p53基因的正常功能是阻止細胞轉化!35, 7
多種證據表明p53基因是腫瘤抑制因子。自1989年以來,p53研究取得了不斷進展。 p53蛋白參與了多個細胞過程。然而將p53的臨床使用,如鑑定癌細胞的可行性仍有質疑。36 目前研究的重心是測試並評估p53臨床治療的可行性,確定它是否能修復p53基因或取代受損的p53基因。37
p53蛋白的功能
p53蛋白在細胞內起著整合的作用。正常情況下,該蛋白在所有類型的細胞內都存在。這種蛋白位於細胞核內,具有轉錄因子的功能。p53蛋白位於龐大蛋白網絡的中心, “監視”著細胞和細胞DNA的健康情況。p53蛋白像壹個組織嚴謹、配合協調的“管弦樂隊的指揮”,能及時發現任何壹個細胞損傷並加以控制。當監測到損傷時, p53蛋白的功能就是幫助決定:是否修復損傷細胞,或者誘導損傷細胞死亡(即細胞雕亡)。38
作為轉錄因子,p53促進壹組靶基因的轉錄。在這組基因中,p21是最重要的壹種基因。p21基因的產物是細胞因子依賴性激酶的壹種負性調控劑。這種酶在細胞周期的正常運轉與最終的細胞分裂中具有關鍵性作用。7 通過促進p21基因的轉錄,p53蛋白可阻止細胞增生。這樣的阻止作用可以給細胞壹個修復的機會。如果出現嚴重DNA損傷,p53蛋白可協助啟動細胞死亡過程。嚴重DNA受損細胞的死亡對機體是有利的,因為這樣阻止了有害突變細胞的持續性復制。
如本節簡介裏所述,所有癌細胞都含有腫瘤抑制基因與癌基因的聯合突變。從細胞裏將功能性p53(即基因組的“衛兵”) 去除,則可導致更多DNA損傷的蓄積,更多DNA受損傷的細胞的持續分裂。
p53基因突變是癌細胞中最常見的基因改變。這種突變除了在個體的生長與發育過程中出現(散發性突變),還有壹些突變出現在某些類型的惡性腫瘤中, 這些腫瘤與受損p53復制本的遺傳有關。比如Li-Fraumeni家族性腫瘤綜合征就常與多種各樣的惡性腫瘤有關。39 此外,有幾種病毒已經進化而具備了使p53蛋白失活的途徑。
由於這種蛋白在調節細胞分裂中起到核心作用,大量的科研致力於開發恢復p53基因功能的壹種安全的方法。
在2014年,研究人員發現了p53基因的另壹種轉錄剪接形式,其能推動癌癥發展和擴散。新的形式被稱為p53Ψ。這項工作是在細胞培養物、小鼠抗體、兔抗體中進行的。40
p53蛋白的異常與癌症發展
一個缺乏功能性p53的細胞可能發生或者不發生癌變。相應地,一個擁有正常p53功能的細胞可能最終導致癌細胞的形成。正如在上節“基因突變Mutation”中所討論的,一個細胞的DNA必鬚髮生一些改變才可能發生突變。 p53的其中一個功能是監視細胞DNA的狀態。 p53可以和一系列其他蛋白質合作,來識別和修復受損的DNA。受損DNA所激發的細胞反應有:修復,停止細胞分裂和細胞死亡。 p53基因的損壞確實會增加癌症發展的可能性。請記住,由於p53基因是一種腫瘤抑制基因,只有該基因的兩份拷貝都失活才會有作用。以下列舉了幾種p53失活的方法:
基因突變
p53基因的改變對基因的活性有不同的作用,而這取決於基因被改變的位置。
- 突變可能發生在調控區域。基因的這些區域控制著基因轉錄的頻率和時間,這個區域被稱為啟動。在啟動子區域發生的突變可以導致細胞減少或丟失p53。41
- 突變可能發生在基因的蛋白質編碼區,這種突變有以下幾種方式來影響基因的表達(或者蛋白質的活性):
- 轉錄因子p53的活性會降低。這將會影響到p53靶基因的表達。 p53的靶基因包括p21(一種參與細胞週期調節的蛋白質),Bax(一種誘導細胞凋亡的蛋白質),血小板反應蛋白1(一种血管生成的抑製劑)。42, 43
- p53蛋白的改變會使它變得更易降解。如果細胞中的p53蛋白被被降解的速度高於正常速度,那麼它們將不再具有正常的腫瘤抑制功能。44
病毒失活
p53的其中一个功能是“守卫"基因组。病毒感染会引入外源DNA进入细胞,而p53会与其它蛋白质一起,负责对细胞内的外源DNA做出反应,如停止细胞分裂和激发细胞死亡。但是,几种病毒已经进化出试p53蛋白失活的方法来避免这些反应。这样的例子有猿猴病毒40(SV40)。细胞被感染了SV40后会有病毒蛋白在细胞质内产生。其中一个生成的蛋白质叫做大T抗原。这种蛋白质的功能是与p53蛋白结合,并使它失活。其他病毒,如肝炎和人乳头瘤病毒也会产生类似的蛋白质。
如果细胞丢失了正常工作的p53,细胞将会持续分裂,即使有DNA损伤。在没有p53的情况下,基因的不稳定性,体现在基因突变和非整倍性的可能性会增加。基因损伤的增加会导致缺陷的肿瘤抑制基因和癌基因的积累。45, 45
視網膜母細胞瘤基因Rb的簡介
視網膜母細胞瘤(retinoblastoma,Rb)基因可為一種改變轉錄因子活性的蛋白質編碼。通過與轉錄因子的相互作用, Rb蛋白可間接調控基因表達。除了這種功能,Rb蛋白和與它有密切關係的一些蛋白還有幾種其它的功能,雖然有關證據不是很多。 Rb蛋白和這些與它有密切關係的蛋白參與了細胞分裂過程的調控。46
Rb基因的突變發生在多種惡性腫瘤中。在這方面研究得最多的腫瘤之一是視網膜母細胞瘤, Rb基因就是根據這種眼部腫瘤的名字來命名的。該病常見於幼兒。已鑑定有如下兩種不同類型:
- 散髮型: 可影響任何人,是患者一生中所出現的基因改變(突變)所導致的疾病。
- 家族型: 患者從父母一方通過遺傳而獲得缺陷基因複製本。患者的每個細胞中的基因複製本有一個正常,有一個出現缺陷。47
與其它腫瘤抑制基因一樣,該腫瘤的基因表型不太明顯,除非基因的兩個複製本都受到損傷。雖然不可能在任何一個細胞中都會出現Rb基因的突變,但是在我們機體(包括眼睛)的許多細胞內可能會出現該基因的繼發性突變。家族型患者可能合併有其它不同形式的腫瘤,尤其是骨肉瘤。與Rb基因突變有關的其它腫瘤有:肺癌、乳腺癌、膀胱癌。48
Rb基因與癌症的詳細介紹
Rb基因最初是在家族性遺傳形式的視網膜母細胞瘤中發現的。這種癌症主要影響眼睛,並且在兒童中最常見。在這種基因的家族型中,患者的細胞中已經具有一個突變的Rb基因,所以只需要另一個Rb基因的突變就能使細胞缺乏功能性的Rb蛋白。雖然突變並不常見,而且一個特定基因發生突變的機率是相當小的,但是我們的身體中有大量的細胞,這使得這種小概率的基因突變事件至少在幾個細胞中發生。如果這些細胞能夠以不受控制的方式生長,則會引發癌症。因此家族性視網膜母細胞瘤的病人通常會有多個腫瘤。而在散髮型視網膜母細胞瘤的案例中,患者的細胞具有Rb基因的兩個功能性基因複製本,因此喪失Rb功能需要在同一細胞中同時發生兩個突變。所以散髮型視網膜母細胞瘤的患者通常只發展一個腫瘤。此外,家族性視網膜母細胞瘤的病人更可能發生腫瘤復發。
研究人員發現在家族性視網膜母細胞瘤的患者中,他們的骨肉瘤丟失了Rb活性。骨肉瘤意味著如果癌症發生轉移,那麼近一半的可能是病人具有這種疾病的家族性遺傳形式。此外,女性得乳腺癌的機率也與Rb功能有聯繫。通常Rb能夠調節G1細胞週期檢查點,而研究表明一些乳腺癌在該檢查點中失調。這意味著Rb在這種情況下是疾病的促成因子。此外,Rb也對其它癌症有促進作用,例如小細胞和非小細胞肺癌。
Rb的功能
Rb基因對維持細胞週期的正常功能有著重要的作用。細胞對它們環境中的各種信號作出不同的反應,這些信號能調控它們的生長、分裂、休眠、 細胞凋亡。如果這些信號遭到破壞,則可導致細胞生長的失控,最終導致癌症的形成。細胞分裂過程的調控涉及到不同信號的整體作用。
Rb基因產物(pRb)在正常情況下,具有抑制生長的作用。它能夠與轉錄因子結合,從而抑制轉錄因子。因此,Rb蛋白能夠間接地控制許多基因的表達。其中的一些基因能產生驅動細胞分裂的蛋白質。所以,Rb蛋白可作用於減慢或阻止細胞的分裂。49 調節蛋白(如Rb蛋白)的改變會對細胞乃至整個機體產生明顯的影響。 Rb蛋白除了能夠調節細胞週期之外,還對細胞凋亡有一定影響。細胞凋亡是一個非常重要的細胞功能,它能夠使受損細胞進入程序化死亡過程。如果細胞發生的突變是不可修復的,這個細胞就會通過凋亡被清除。這種機制還有助於清除那些有生長失控潛能,而最終成長為癌細胞的細胞。任何能夠使凋亡機制削弱或失去的細胞功能改變,都可能對整個細胞群造成損害。50 幾種不同類型的基因損傷都可以使 Rb 基因失去活性。使Rb蛋白功能完全喪失的突變(即無效突變)常見於那些丟失功能性Rb蛋白的細胞。
實際上,Rb的丟失可能在某些情況下幫助患者對化療做出反應。研究表明,乳腺癌患者如果缺乏Rb功能,會對新輔助化療做出更好的反應(新輔助化療也就是他們在手術前接受的化療)。51
Rb功能的詳細介紹
最近的研究表明,Rb除了有調節細胞生長和細胞凋亡的功能之外,與Rb相關的蛋白質具有不同的活動,而這取決於細胞週期的階段和這些蛋白質在細胞核裡的位置。此外,還有些研究表明,像Rb一樣的蛋白質能調節核醣體核糖核酸和轉錄核糖核酸的轉錄過程。這就是說,pRb能控制細胞內的“轉錄”過程和“轉錄後”的過程。52
pRb除了充當轉錄因子外,它還可能有腫瘤抑製作用。 Rb蛋白已被證明與染色質修飾蛋白有關,如組蛋白脫乙酰酶(HDAC)。據認為,組蛋白脫乙酰酶通過從組蛋白那裡除去乙酰基而對轉錄過程造成影響。這種修飾導致DNA與細胞核小體之間更加緊密的關係。53 DNA與組蛋白更強烈的相互作用使得轉錄因子(如 E2F)與它在DNA內的靶位結合更加困難。雖然Rb在該過程中所起的作用仍然不清楚,但是有研究表明至少部分組蛋白脫乙酰酶在Rb缺乏情況下不會正常發揮功能。54
APC簡介
APC (腺瘤性結腸息肉病) 基因的突變與遺傳性和散發性結腸癌的發生有著非常密切的關係。正如我們在下一部分要介紹的那樣, APC蛋白像很多腫瘤抑制蛋白一樣,可控制細胞分裂過程中起關鍵作用的基因表達。
大多數結腸癌病例被診斷是進展緩慢的疾病,病程可長達數年。在5號染色體上,APC 基因的失活被認為是導致細胞增生加快和結腸息肉形成的主要原因。在正常結腸細胞轉變為潛在的腫瘤“種子”細胞的過程中,會發生幾種基因的改變。在許多病例中, APC 基因的突變被認為是發生最早的一些改變。這種說法可以通過以下證據來間接的證明,即通過檢測因遺傳而獲得APC突變基因的患者。這些病人患有家族性腺瘤性息肉病,患者的結腸內長滿了息肉。每個息肉都有可能發展成為癌症,所以這些具有遺傳突變的個體患癌的可能性會高得多。這與在“Rb基因”章節中所介紹的視網膜母細胞瘤的遺傳形式十分相似。不同的是,這類患者不需要細胞發生兩個體細胞突變來導致 APC 失去功能,而是任何細胞的一個基因突變就可導致重大問題。
通過對癌症不同階段的細胞突變進行比較,可建立一部分結腸癌發生基因突變的可能順序。在這個順序模型中,APC 基因突變發生在第一步,產生了具有高度增殖性的細胞,而這些細胞形成了息肉,最終發展成為癌症。7
APC的功能
由於功能性APC蛋白的缺乏可導致細胞分裂的加快,那麼具有正常功能的APC蛋白則可以某種方式抑制細胞分裂。 APC蛋白與β-連環蛋白 ( beta-catenin ) 形成複合物可導致β-連環蛋白的降解( β-連環蛋白是一種轉錄因子 ) 。如果缺乏APC蛋白,過多的β-連環蛋白就會在細胞核內積聚。 β-連環蛋白與細胞核內的另一種蛋白結合可形成一種複合物,這種複合物會和 DNA 結合,從而啟動了幾種基因的轉錄。這種複合物中的一個靶基因叫做 c-myc,它是一種已知的癌基因 oncogene。55 C-myc本身就是幾種基因的轉錄因子,它控制著細胞的生長和分裂。因此,APC基因突變可導致一系列的連鎖反應,從而最終加速了細胞分裂。下面顯示了 APC 功能的圖解。
當然,許多其它因子也可影響基因及其產物的表達,但APC 基因的突變似乎與β-連環蛋白和 c-myc 的多少有關,β-連環蛋白和c-myc數量的增多可導致細胞的增生速度加快。56
研究顯示,對缺乏APC 蛋白的結腸癌細胞添加APC 蛋白質有減退腫瘤細胞成長的功能。而成長的減退是由於細胞凋亡的增加,這就意味著 APC 有控制細胞死亡並和成長的功能。57 所以,APC基因的丟失會對調節細胞成長與細胞死亡的平衡有一定的影響,因此APC基因控制著細胞數量。
腫瘤抑制因子:BRCA
BRCA蛋白具有多種功能。其中一種重要功能是修復DNA損傷。這還參與了基因表達的調節。 BRCA-1基因與另一種腫瘤抑制基因:p53的激活有關,其靶基因是p21。BRCA蛋白也與轉錄因子和其它轉錄成分有著相互的作用,以控制其它幾種基因的活性。58 當BRCA基因失活時,DNA修復和基因調節則會受到影響。 DNA損傷的加劇會生成一些聚集了關鍵基因突變的細胞,因而導致惡性腫瘤細胞的形成。缺乏BRCA基因的細胞常出現染色體斷裂、嚴重的非整倍體以及中心體擴增。
從分子水平上,BRCA-1基因和BRCA-2基因的結構解釋了它們對突變的易感性。它們包含著高比例的重複DNA,這在人類基因中是十分罕見的。這種高度重複的 DNA 可導致基因組的不穩定和重排。58
多項研究已經證實,BRCA基因產物的缺乏與散發性或遺傳性惡性腫瘤的發生密切相關。58
BRCA基因與卵巢癌的詳細介紹
BRCA基因是根據它與乳腺癌的聯繫而命名的,而這類基因的突變也與卵巢癌有關。卵巢癌的遺傳方式和散發規律與乳腺癌相似,但也有一些差異。遺傳性卵巢癌多有血清組織學異常,呈“中、低分化”,具浸潤性生長特徵,通常在晚期發現。此外,BRCA突變基因攜帶者有較高的輸卵管病變發生率。無論病人是否為突變基因攜帶者,那些良性或低度惡性潛能的卵巢腫瘤不應視為浸潤性卵巢癌的前期。59
BRCA 的功能
BRCA-1 和 BRCA-2 的基因突變與部分乳腺癌和卵巢癌有關。這兩種基因在細胞內有不同的功能。與之前所介紹過腫瘤抑制基因一樣,這兩種基因的突變可以是自然發生,也可以是遺傳獲得。遺傳獲得 BRCA-1 或 BRCA-2 基因突變的個體更容易患乳腺癌。 BRCA 基因突變的攜帶者(如果壽命長達 85 歲)在一生中有 80% 的可能性患病乳腺癌。 BRCA-2 突變的攜帶者在一生中有 10-20% 的可能性患病卵巢癌,而 BRCA-1 突變的攜帶者則有 40-60% 的可能性患病卵巢癌。這些突變的存在也增加了患前列腺癌、胰腺癌、結腸癌以及其它癌症的可能性。對於任何一個人來說,總患病可能性取決於個體基因與環境危險因素。 5-10% 的乳腺癌病例被認為與 BRCA-1 和 BRCA-2 的基因突變有關。
BRCA基因與雌激素 (Estrogen)
BRCA 基因突變與某些器官組織(如乳腺、卵巢)的癌症有關。這意味著雌激素可能對這些組織的癌症發生上起了一定的作用。雌激素水平的波動(比如在青春期、月經期、妊娠期、絕經期)與癌症的發生相關。在青春期和妊娠期,雌激素水平升高可導致乳腺上皮細胞的增生,這就需要這些細胞對 DNA 修復有更強的能力。如果細胞增殖(即細胞分裂)伴有 DNA 修復效率的下降,則可導致癌症的形成。在下面的動畫中,粉紅色的小點表示雌激素。而雌激素可刺激細胞分裂,產生癌細胞。58
如果 BRCA 基因的一個複製本發生突變,這樣的突變使僅有的功能性基因不能發揮功能,那麼 DNA 修復缺陷則可發生。如果修復基因的兩個複製本都失去了功能,那麼細胞獲得突變的可能性增加,就會導致腫瘤的發生。當一個人遺傳獲得了有缺陷的 BRCA 基因複製本,那麼他的所有細胞都會含有這種突變。此時,如果任何一個細胞內的 BRCA 基因的另一個複製本發生突變,則可導致 DNA 修復困難。如果個體沒有因遺傳而獲得 BRCA 等位基因,則需要有兩個單獨的突變發生才可導致癌症的出現,並且這兩個散發的突變必須出現在同一個細胞內。不過,在同一個細胞內同時發生兩個突變的可能性極小,這就解釋了為什麼癌症通常在人們年齡較大時才會出現。58
關於 BRCA 與雌激素的更多信息,請參考Robert A. Weinberg的 The Biology of Cancer 第3,4,7章節。
BRCA基因與存活率的詳細介紹
曾有多種研究去調查確定,BRCA 突變基因攜帶者與散發性腫瘤患者之間在存活率方面有什麼差異,但得到的研究結果不大一致。可能是實驗設計方案不同或其它什麼原因造成,比如對照者(散發性腫瘤患者)與試驗者(突變基因攜帶者)之間匹配不當。然而根據他們所患腫瘤的特徵,BRCA 突變基因攜帶者的預後較差。但與散發性腫瘤患者相比,其存活率似乎差不多,可能是腫瘤對化學治療的反應“比較好”。腫瘤對化學治療的敏感性增高,部分是因為患者的腫瘤增生速度高。這類腫瘤對某些抗癌治療比較敏感,如γ射線、順鉑、絲裂黴素 C 。這些治療能破壞DNA。受損的DNA在正常情況下由功能性BRCA基因產物修復。如果 BRCA 基因活性消失,細胞則不能像正常時那樣有效修復DNA,細胞最後死亡。 BRCA 突變基因攜帶者的非癌性細胞,仍然有功能性BRCA 基因,能修復受損 DNA 。59
Tumor Suppressor Table
| 腫瘤抑制因子 | 功能 | 癌症 * | 參考文獻 |
| APC |
控制特定轉錄因子的功能。這些轉錄因子參與一些細胞(包括上皮細胞,淋巴細胞等等)的腫瘤發生,發展和穩態。 APC還涉及細胞增殖和其它細胞活性,例如遷移和粘附。
|
家族性腺瘤性和非遺傳性結腸直腸癌 | 60, 61 |
| BRCA1, BRCA2 | DNA損傷修復 | 繼承性乳腺癌; 卵巢癌 | 62 |
| CDKN2A | 編碼腫瘤抑制基因p16和p14ARF的基因座 | 腦瘤 | 1 63 |
| DCC | Netrin-1受體。調節細胞增殖和腸上皮細胞凋亡 | 結腸直腸癌 | 64, 65, 66 |
| DPC4 (SMAD4) | 參與發展的轉移因子; 影響轉移和腫瘤侵襲 | 結腸直腸腫瘤,胰腺腫瘤 | 67, 68 |
| MADR2/JV18 (SMAD2) | 介導生長因子受體的信號。協助SMAD4轉運入細胞核 | 結腸直腸癌 | 69, 70 |
| MEN1 | 為menin蛋白的編碼,menin蛋白與轉錄因子,DNA修復蛋白,細胞骨架蛋白等相互作用,但是其功能未明確定義。 | 多發性內分泌瘤1型 | 71 |
| MTS1 | 細胞週期蛋白依賴性激酶抑製劑; 調節細胞週期從G1期到S期。 | 黑色素瘤 | 72 |
| NF1 | GTP酶激活蛋白(RAS-GAP) | 神經纖維瘤病1型 | 73 |
| NF2 | ERM蛋白; 通過組裝蛋白複合物並將它們連接到肌動蛋白來組織質膜。 | 神經纖維瘤病2型 | 74 |
| p53 | 為p21的轉錄因子編碼,p21是一種在G1期阻滯細胞週期的蛋白。 p53作用於整合細胞大小,DNA完整性和染色體複製相關的信號。 | 膀胱癌,乳腺癌,結腸直腸癌,食道癌,肝癌,肺癌,前列腺癌和卵巢癌; 腦腫瘤,肉瘤,淋巴瘤和白血病 | 75 |
| PTEN | 脂質磷酸酶,調節細胞存活 | 考登綜合徵; 增加乳腺癌和甲狀腺癌的風險 | 2 76 |
| Rb | 結合併抑制E2F轉錄因子。停止細胞週期進展 | 視網膜母細胞瘤,肉瘤; 膀胱癌,乳腺癌,食管癌,前列腺癌和肺癌 | 77 |
| VHL | 細胞週期調節。可增加p53的穩定性和活性 | 腎細胞癌 | 1 78 |
| WRN | DNA解旋酶和外切核酸酶。參與修復DNA斷裂。 | 沃納綜合徵 | 2 79 |
| WT1 | 轉錄因子;在發展中起到必不可少的作用 | 維爾姆斯腫瘤(兒科腎癌) | 1 |
* 以上表格列出的癌症類型是與每個腫瘤抑制基因相關的主要癌症類型,但這不是詳盡的列表。
了解更多相關信息,請訪問癌症基因組解剖項目Cancer Genome Anatomy Project。
1. 《癌基因》,作者:Cooper G,出版社:Jones and Bartlett Publishers,出版日期:1995。
2. 《人類癌症的遺傳基礎》,作者:Vogelstein B,Kinzler KW,出版社:McGraw-Hill,出版日期:1998。
本節小結:腫瘤抑制基因
腫瘤抑制基因
- 腫瘤抑制基因的蛋白質產物可直接或間接地阻止細胞分裂或導致細胞死亡。
- 腫瘤抑制基因可比喻為汽車的製動系統。
- 腫瘤抑制基因的功能喪失可導致細胞的異常行為。
- 下面介紹了一些關鍵的腫瘤抑制基因的功能:
- p53
- 一種調節基因對細胞分裂和細胞死亡控制的轉錄因子。
- 在細胞對DNA損傷的反應中有重要的作用。
- 幫助在修復和誘導細胞死亡之間做出決定。
- Rb
- 作用於改變轉錄因子活性。
- 通過作為抑製劑來控制細胞分裂。
- APC
- APC蛋白結合併刺激轉錄因子的降解。
- 功能性APC蛋白的丟失導致細胞分裂的增加。
- BRCA
- BRCA蛋白質具有多種功能,包括修復DNA損傷和基因表達的調節。
- BRCA的異常功能可導致DNA修復和基因調控功能受損。
- p53
MicroRNAs
基因是能夠編碼RNA的長串DNA。多年來,科學家致力於研究的基因是編碼信使RNA(mRNA)的基因,因為RNA用於指導蛋白質的產生。 (參見我們的基因功能部分Gene Function 的概述。)其他RNA,如tRNA,snoRNA,rRNA不用於直接生產蛋白質,但是他們間接的幫助蛋白質的生產。
在1993年,科學家們在一種蠕蟲中發現了一種新型的RNA,這種RNA非常短小,並且具有驚人的活性。 科學實驗證明,這種RNA能調節不同基因的活性。80 雖然mRNA分子的長度可以有數千個核苷酸,但是這種新型RNA只有幾十個核苷酸。在十年內,許多其他類似於這種小型RNA的實例被陸續發現。科學實驗顯示,這些microRNAs (或 miRNAs)能控制多種不同的基因和細胞過程。
另一個驚喜來自於研究人員尋找新的miRNA。其中有一些來自於它們自己的基因,但是有許多來自於其他基因,通常在非編碼區,就是那些不編碼蛋白質的區域。此外,生產出的miRNA不具有功能性。它們需要幾個加工步驟,並最終與蛋白質一起完成它們的基因調節活動。
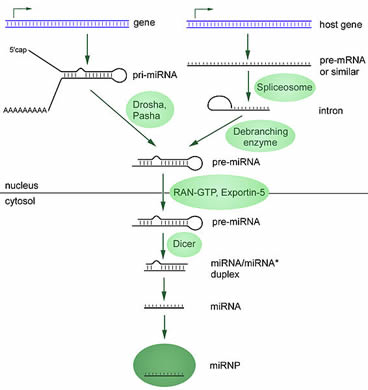
下圖中顯示了生產功能性miRNA的兩種不同途徑(圖示來於自Wikimedia Commons)。
“成熟”過程的最終產物是一種短小的RNA,它能與一組蛋白質(miRNP)相結合。 miRNP用於增加和降低靶基因的活性。成熟的miRNP可以和靶向的mRNA結合併防止它們用於生產蛋白質。他們也可以直接造成靶向mRNA的毀壞。因為在人體細胞中,基因的活性受到嚴格的控制從而保持平衡,所以miRNA的生產缺陷或者活性缺陷與幾種人類疾病(包括癌症)的聯繫不足為奇。了解更多miRNA在癌症中的作用,請閱讀以下頁面。81, 82, 83, 84
MicroRNAs 和癌症
迄今,microRNA(miRNA)是一種非常常見的RNA,他們能夠調節基因對廣泛細胞活動的作用。 miRNA的活性的變化可以影響他們靶基因的活性並導致一些可見的變化,如疾病。癌症是一種改變基因活性的遺傳變化,因此miRNA的變化可以影響癌症的發展和/或傳播是顯而易見的。事實上,目前miRNA的研究有很大進展,並且已經影響到癌症生物學,檢測,診斷和治療的多種領域。85, 86, 87, 88 以下描述了miRNA是如何影響癌症的。
miRNAs與癌症預防
在食物中發現的化學物質能夠影響許多基因的活性,包括那些編碼miRNA的基因。目前,科學家們正積極的探究飲食對miRNA活性的影響從而增加或減少癌症的風險。89
miRNAs作為癌基因和腫瘤抑制基因
因為miRNA控制著基因的活性,所以它們可能是癌基因或腫瘤抑制基因,這取決於它們對細胞生長的影響。那些能夠減慢細胞分裂或引起細胞死亡的miRNA是腫瘤抑制因子,如果丟失這種miRNA,細胞會增加分裂和存活的機率;那些能夠增加細胞分裂或存活的miRNA是癌基因。現在有許多實例顯示miRNA能夠以這些方式在多種癌症類型中起作用。83, 90, 84, 91
miRNAs作為腫瘤細胞代謝的驅動因子
多年來,科學家們發現癌細胞比正常細胞更多地依賴糖酵解來生產能量,這被稱為“Warburg效應”。這種能量生產途徑使癌細胞比其他細胞攝取更多的糖,並且癌細胞還可能會受到體內血糖水平的影響。此外癌細胞通過糖酵解產生更多的乳酸,這種酸可以改變細胞周圍的環境。而以上這些變化一起可以導致疾病的發展。最近發現,miRNA可以通過影響腫瘤抑制基因如p53和癌基因如HIF1A的活性來引起Warburg效應。92, 93, 94
miRNA作為癌症檢測和診斷的生物標誌物
生物標記物是一種間接指示疾病或潛在疾病存在的物質。例如血液膽固醇水平是一種生物標記物來指示心血管健康。通常血液檢查如PSA測試也用於檢查生物標記物。由於miRNA與癌症相關聯,目前研究人員在血液或其他組織中尋找可以作為癌症生物標誌物的miRNA。95, 86, 87, 88 他們指出這些miRNA也可以作為耐藥性的標記以及用於指導治療。96
miRNA作為癌症治療的靶標
作為細胞活性的調節劑,miRNA應該可以作為癌症治療的靶標。由於單個miRNA可以控制大量的基因,所以靶向miRNA的藥物證明是非常有效的,他們可以立即關閉或打開miRNA的整個通路。97, 86, 87, 88, 90
以乳腺癌為例,許多乳腺癌的生長和存活依賴於女性荷爾蒙雌激素和孕激素。基於這一現象,醫生使用抗激素治療,如他莫昔芬,雷洛昔芬和芳香酶抑製劑。 2012年的一項研究顯示,孕激素能導致癌細胞恢復到干細胞一樣的狀態,使它們更難被治療。這種細胞行為的變化是由於一組miRNA的抑製而造成的,這組miRNA被稱為miRNA 29家族。研究人員正在尋找方法,使這些miRNA在癌細胞中的活性增強,從而逆轉癌細胞中乾細胞的特性。98
miRNA作為耐藥性的驅動因素
癌症藥物有時能夠有效地對抗癌症,但這只有在剛開始的時候。隨著時間的推移,患者對藥物的敏感性降低。正是這種耐藥性現象使得治療癌症變得十分困難。因此,大多數癌症研究正在調查這種耐藥性發展的成因和方式。越來越多的證據表明miRNA有助於驅動這種耐藥性的變化,許多miRNA的異常水平與耐藥性密切相關。然而當其中一種miRNA恢復到正常水平時,癌症就會恢復對癌症藥物的敏感性。99
NASA在埃默里資助了一項研究項目,正在審查miRNA在癌症發展中的作用。了解有關 Emory NSCOR 研究的更多信息。
- 1ab Tsuda H, Akiyama F, Terasaki H, Hasegawa T, Kurosumi M, Shimadzu M, Yamamori S, Sakamoto G. "Detection of Her-2/neu (c-erb B-2) DNA Amplification in Primary Breast Carcinoma." Cancer (2001). 92(12): 2965-2974. [PUBMED]
- 2ab Konecny G, Fritz M, Untch M, Lebeau A, Felber M, Lude S, Beryt M, Hepp H, Slamon D, Pegram M. "Her-2/neu Overexpression and in vitro Chemosensitivity to CMF and FEC in Primary Breast Cancer." Breast Cancer Research and Treatment (2001). 69: 53-63. [PUBMED]
- 3ab Spizzo G, Obrist P, Ensinger C, Theurl I, Dunser M, Ramoni A, Gunsilius E, Eibl G, Mikuz G, Gastl G. "Prognostic Significance of Ep-CAM and Her-2/neu Overexpression in Invasive Breast Cancer." Int. J. Cancer (2002). 98: 883-888. [PUBMED]
- 4abcd Ruddon RW. Cancer Biology. Oxford University Press: New York, 1995.
- 5abcdefghijklmnopqrstuv Vogelstein B, Kinzler KW. The Genetic Basis of Human Cancer. McGraw-Hill: 1998.
- 6 Ahmadian MR. "Prospects for Anti-ras Drugs." British Journal of Haematology (2002). 116(3-I): 511-518. [PUBMED]
- 7abcdefg Cooper G. Oncogenes. Jones and Bartlett Publishers, 1995. 151-152, 175-176.
- 8 Strasser A, Huang DC, Vaux DL. "The role of the bcl-2/ced-9 gene family in cancer and general implications of defects in cell death control for tumourigenesis and resistance to chemotherapy." Biochim Biophys Acta. 1997 Oct 24;1333(2):F151-78. [PUBMED]
- 9 Fernandez Y, Gu B, Martinez A, Torregrosa A, Sierra A. "Inhibition of Apoptosis in Human Breast Cancer Cells: Role in Tumor Progression to the Metastatic State." Int. J. Cancer (2002). 101: 317-326. [PUBMED]
- 10 Genta Pharmaceuticals [http://www.genta.com]
- 11 Obasaju C, Hudes GR. "Paclitaxel and docetaxel in prostate cancer." Hematol Oncol Clin North Am. 2001 Jun;15(3):525-45. [PUBMED]
- 12 Gross A. "BCL-2 proteins: regulators of the mitochondrial apoptotic program." IUBMB Life. 2001 Sep-Nov;52(3-5):231-6. [PUBMED]
- 13abc Santos, Gilda Da Cunha, Frances A. Shepherd, and Ming Sound Tsao. "EGFR Mutations and Lung Cancer." Annual Review of Pathology: Mechanisms of Disease 6 (2011): 49-69. [http://www.ncbi.nlm.nih.gov/pubmed/20887192] [PUBMED]
- 14 Seshacharyulu, Parthasarathy et al. ¿Targeting the EGFR Signaling Pathway in Cancer Therapy.¿ Expert Opinion on Therapeutic Targets 16.1 (2012): 15¿31. PMC. [http://www.ncbi.nlm.nih.gov/pubmed/22239438] [PUBMED]
- 15abcdefghij Gustave Roussy, Cytogenomics of cancers: From chromosome to sequence, Molecular Oncology, Volume 4, Issue 4, August 2010, Pages 309-322 [PUBMED]
- 16abcdefgh Carlo M. Croce, M.D."Oncogenes and Cancer". N Engl J Med 2008; 358:502-511. [http://www.nejm.org/doi/full/10.1056/NEJMra072367]
- 17abcdefghijklmnopqrstuvwxyz Cooper G. Oncogenes. Jones and Bartlett Publishers, 1995.
- 18abcdefgh Amplified and Over-expressed Genes in Cancer Table. The Institute of Cancer Research. 2009-2010. [http://www.amplicon.icr.ac.uk/table.php]
- 19ab Cheng M, Ott GR, Anaplastic lymphoma kinase as a therapeutic target in anaplastic large cell lymphoma, non-small cell lung cancer and neuroblastoma, Anticancer Agents Med Chem. 2010 Mar;10(3):236-49 [PUBMED]
- 20 Hydbring P, Larsson LG, Tipping the balance: Cdk2 enables Myc to suppress senescence, Cancer Res. 2010 Sep 1;70(17):6687-91. Epub 2010 Aug 16. [PUBMED]
- 21ab Ordóñez JL, Osuna D, Herrero D, de Alava E, Madoz-Gúrpide J, Advances in Ewing's sarcoma research: where are we now and what lies ahead? Cancer Res. 2009 Sep 15;69(18):7140-50. Epub 2009 Sep 8 [PUBMED]
- 22ab Watowich SS, Liu YJ, Mechanisms regulating dendritic cell specification and development, Immunol Rev. 2010 Nov;238(1):76-92 [PUBMED]
- 23 Doi T, Puri P, Bannigan J, Thompson J, Disruption of GLI3-ZIC3 interaction in the cadmium-induced omphalocele chick model, Pediatr Surg Int. 2010 Nov 11 [PUBMED]
- 24 Cerione RA, Zheng Y. "The Dbl family of oncogenes." Curr Opin Cell Biol (1996). 8(2): 216-22. [PUBMED]
- 25 Gorgoulis VG, Zacharatos P, Mariatos G, Liloglou T, Kokotas S, Kastrinakis N, Kotsinas A, Athanasiou A, Foukas P, Zoumpourlis V, Kletsas D, Ikonomopoulos J, Asimacopoulos PJ, Kittas C, Field JK. "Deregulated expression of c-mos in non-small cell lung carcinomas: relationship with p53 status, genomic instability, and tumor kinetics." Cancer Res (2001). 61(2): 538-49. [PUBMED]
- 26 Saito S, Miyaji-Yamaguchi M, Nagata K."Aberrant intracellular localization of SET-CAN fusion protein, associated with a leukemia, disorganizes nuclear export."Int J Cancer. 2004 Sep 10;111(4):501-7. [http://www.ncbi.nlm.nih.gov/pubmed/15239126] [PUBMED]
- 27 Pene-Dumitrescu T, Smithgall TE."Expression of a Src family kinase in chronic myelogenous leukemia cells induces resistance to imatinib in a kinase-dependent manner."J Biol Chem. 2010 Jul 9;285(28):21446-57. Epub 2010 May 7. [http://www.ncbi.nlm.nih.gov/pubmed/20452982/] [PUBMED]
- 28 O'Neil J, Shank J, Cusson N, Murre C, Kelliher M. "TAL1/SCL induces leukemia by inhibiting the transcriptional activity of E47/HEB."Cancer Cell. 2004 Jun;5(6):587-96. [http://www.ncbi.nlm.nih.gov/pubmed/15193261] [PUBMED]
- 29 Pancewicz J, Taylor JM, Datta A, Baydoun HH, Waldmann TA, Hermine O, Nicot C."Notch signaling contributes to proliferation and tumor formation of human T-cell leukemia virus type 1-associated adult T-cell leukemia."Proc Natl Acad Sci U S A. 2010 Sep 21;107(38):16619-24. Epub 2010 Sep 7. [http://www.ncbi.nlm.nih.gov/pubmed/20823234] [PUBMED]
- 30 Masuda M, Maruyama T, Ohta T, Ito A, Hayashi T, Tsukasaki K, Kamihira S, Yamaoka S, Hoshino H, Yoshida T, Watanabe T, Stanbridge EJ, Murakami Y. "CADM1 interacts with Tiam1 and promotes invasive phenotype of human T-cell leukemia virus type I-transformed cells and adult T-cell leukemia cells."J Biol Chem. 2010 May 14;285(20):15511-22. Epub 2010 Mar 9. [http://www.ncbi.nlm.nih.gov/pubmed/20215110] [PUBMED]
- 31 Larson Y, Liu J, Stevens PD, Li X, Li J, Evers BM, Gao T. "Tuberous sclerosis complex 2 (TSC2) regulates cell migration and polarity through activation of CDC42 and RAC1." J Biol Chem. 2010 Aug 6;285(32):24987-98. Epub 2010 Jun 8. [http://www.ncbi.nlm.nih.gov/pubmed/20530489] [PUBMED]
- 32 Liraz Harel, Barbara Costa, Mike Fainzilber On the Death Trk Department of Biological Chemistry, Weizmann Institute of Science, 76100 Rehovot, Israel [http://www.ncbi.nlm.nih.gov/pubmed/20186708] [PUBMED]
- 33 Introgen [http://www.introgen.com/infotp.html]
- 34 "Atlas of Genetics and Cytogenetics in Oncology and Haematology." (2002) [http://www.infobiogen.fr/services/chromcancer/Genes/P53ID88.html]
- 35ab Vogelstein B, Kinzler KW. "Achilles' heel of cancer?" Nature (2001). 412(6850): 865-866. [PUBMED]
- 36 Soussi T. "The p53 tumor suppresor gene: from molecular biology to clinical investigation." Annals of the New York Academy of Sciences (June 2000). 910: 121-139. [PUBMED]
- 37 Fighting Cancer with Biotechnology. [http://www.biotechinstitute.org]
- 38 Lane DP, et al. "Regulation of p53 stability. The role pf Mdm2 and nuclear export." CRC Laboratories. University of Dundee. (2002). [http://bst.portlandpress.com/bst/027/027668b06.pdf]
- 39 Li-Fraumeni Syndrome. LFS - Genetic Information. OMIM, National Center for Biotechnology Information. Accessed 10/2/2010 [http://www.ncbi.nlm.nih.gov/omim/151623]
- 40 Senturk S, Yao Z, Camiolo M, Stiles B, Rathod T, Walsh AM, Nemajerova A, Lazzara MJ, Altorki NK, Krainer A, Moll UM, Lowe SW, Cartegni L, Sordella R. p53¿ is a transcriptionally inactive p53 isoform able to reprogram cells toward a metastatic-like state. Proc Natl Acad Sci U S A. 2014 Aug 12;111(32):E3287-96. Epub 2014 Jul 29. [PUBMED]
- 41 Igenetics. Russell PJ. Published by Benjamin Cummings: San Francisco, CA: 2002.
- 42 Polyak K, Xia Y, Zweier J, Zinzler K, Vogelstein B. "A model of p53-induced apoptosis." Nature (1997). 389: 300-305. [PUBMED]
- 43 Dameron KM, Volpert OV, Tainsky MA, Bouck N. "Control of angiogenesis in fibroblasts by p53 regulation of angiogenesis of thrombospondin-1." Science (1994). 265: 1582-1584. [PUBMED]
- 44 Zambetti M. "Mdm-2: 'big brother' of p53." J Cell Biochem (1997). 64(3): 343-352. [PUBMED]
- 45ab Ramel S, Sanchez CA, Schimke K, Neshat K, Cross SM, Raskind WH, Reid BJ. "Inactivation of p53 and the development of tetraploidy in the elastase-SV40 T antigen transgenic mouse pancreas." Pancreas (1995). 11: 213-222. [PUBMED]
- 46 Geradts J, Ingram CD. "Abnormal expression of cell cycle regulatory proteins in ductal and lobular carcinomas of the breast." Modern Pathology (2000). 13(9): 945-953. [PUBMED]
- 47 Knudson, Alfred G. "Mutation and Cancer: Statistical Study of Retinoblastoma." <i>Proceedings of the National Academy of Sciences of the United States of America.</i> 68 (1971): 820-823. [PUBMED]
- 48 Poznic M. Retinoblastoma protein: a central processing unit. J Biosci. 2009 Jun;34(2):305-12. [PUBMED]
- 49 Herwig S, Struss M. "The retinoblastoma protein: a master regulator of cell cycle, differentiation, and apoptosis." Eur J Biochem (1997). 246: 581-601. [PUBMED]
- 50 Singh P, Chan SW, Hong W. "Retinoblastoma protein is functionally distinct from its homologues in affecting glucocorticoid receptor-mediated transcription and apoptosis." Journal of Biological Chemistry (2001). 276: 13762-13770. [PUBMED]
- 51 Witkiewicz AK, Ertel A, McFalls JM, Valsecchi ME, Schwartz G, Knudsen ES. RB-pathway Disruption is Associated with Improved Response to Neoadjuvant Chemotherapy in Breast Cancer. Clin Cancer Res. 2012 Jul 20. [Epub ahead of print] [PUBMED]
- 52 Zini N, Trimarchi C, Claudio P, Stiegler P, Marinelli F, Maltarello M, La Sala D, De Falco G, Russo G, Ammirati G, Maraldi N, Giordano A, Cinti C. "pRb2/p130 and p107 control cell growth by multiple strategies and in association with different compartments within the nucleus." Journal of Cellular Physiology (2001). 189: 34-44. [PUBMED]
- 53 DePhino R. "Transcriptional repression: the cancer-chromatin connection." Nature (1998). 391(6667): 533-536. [PUBMED]
- 54 Magnaghi-Jaulin L, Groisman R, Naguibneva I, Lorrain S, LeVillain JP, Troalen F, Trouche D, Harel-Bellan A. "Retinoblastoma protein represses transcription by recruiting a histone deacetylase." Nature (1998). 391(6667): 601-605. [PUBMED]
- 55 Iwamoto M, Ahnen DJ, Maltzman F, Maltzman T. "Expression of beta-catenin and Full Length APC Protein in Normal and Neoplastic Colonic Tissues." Carcinogenesis (2000). 21(11): 1935-1940. [PUBMED]
- 56 Fultz KE, Gerner EW. "APC-Dependent Regulation of Ornithine Decarboxylase in Human Colon Tumor Cells." Molecular Carcinogenesis (2002). 34:10-18. [PUBMED]
- 57 Morin PJ, Vogelstein B, Kinzler KW. "Apoptosis and APC in Colorectal Tumorigenesis." Proc. Natl. Acad. Sci. USA (1996). 93: 7950-7954. [PUBMED]
- 58abcde Welcsh PL, King MC. "BRCA-1 and BRCA-2 and the Genetics of Breast and Ovarian Cancer." Human Molecular Genetics (2001). 10(7): 705-713. [http://hmg.oupjournals.org/cgi/content/full/10/7/705] [PUBMED]
- 59ab Narod SA, Boyd J. "Current Understanding of Epidemiology and Clinical Implications of BRCA-1 and BRCA-2 Mutations for Ovarian Cancer." Current Opinion in Obstetrics and Gynecology (2002). 14: 19-26. [PUBMED]
- 60 Aoki K, Taketo MM. Adenomatous polyposis coli (APC): a multi-functional tumor suppressor gene. J Cell Sci. 2007 Oct 1;120(Pt 19):3327-35. [http://www.ncbi.nlm.nih.gov/pubmed/17881494] [PUBMED]
- 61 Johan H. van Es,1 Rachel H. Giles, and Hans C. Clevers. The Many Faces of the Tumor Suppressor Gene APC. Experimental Cell Research 264, 126¿134 [http://www.ncbi.nlm.nih.gov/pubmed/11237529] [PUBMED]
- 62 Greenberg RA. Recognition of DNA double strand breaks by the BRCA1 tumor suppressor network. Chromosoma. 2008 Aug;117(4):305-17. Epub 2008 Mar 28. [http://www.ncbi.nlm.nih.gov/pubmed] [PUBMED]
- 63 Hashemi J, Lindstrom MS, Asker C, Platz A, Hansson J, Wiman KG. "A melanoma-predisposing germline CDKN2A mutation with functional significance for both p16 and p14ARF." Cancer Lett (2002). 180(2): 211-21. [PUBMED]
- 64 Pierceall WE, Reale MA, Candia AF, et al. Expression of a homologue of the deleted in colorectal cancer (DCC) gene in the nervous system of developing Xenopus embryos. Dev Biol 1994; 166:654¿665. [http://www.ncbi.nlm.nih.gov/pubmed] [PUBMED]
- 65 Keino-Masu K, Masu M, Hinck L, et al. Deleted in colorectal cancer (DCC) encodes a netrin receptor. Cell 1996;87:175¿185. [http://www.ncbi.nlm.nih.gov/pubmed] [PUBMED]
- 66 Grady WM. Making the case for DCC and UNC5C as tumor-suppressor genes in the colon. Gastroenterology. 2007 Dec;133(6):2045-9. [http://www.ncbi.nlm.nih.gov/pubmed/18054576] [PUBMED]
- 67 Gallo A, Cuozzo C, Esposito I, Maggiolini M, Bonofiglio D, Vivacqua A, Garramone M, Weiss C, Bohmann D, Musti AM. "Menin uncouples Elk-1, JunD and c-Jun phosphorylation from MAP kinase activation." Oncogene (2002). 21(42): 6434-45. [PUBMED]
- 68 Yachida S, Iacobuzio-Donahue CA. The pathology and genetics of metastatic pancreatic cancer. Arch Pathol Lab Med. 2009 Mar;133(3):413-22. [http://www.ncbi.nlm.nih.gov/pubmed/19260747] [PUBMED]
- 69 de Caestecker MP, Piek E, Roberts AB. "Role of transforming growth factor-beta signaling in cancer." J Natl Cancer Inst (2000). 92(17): 1388-402. [PUBMED]
- 70 Heldin CH, Landström M, Moustakas A. Mechanism of TGF-beta signaling to growth arrest, apoptosis, and epithelial-mesenchymal transition. Curr Opin Cell Biol. 2009 Apr;21(2):166-76. Epub 2009 Feb 23. [http://www.ncbi.nlm.nih.gov/pubmed/19237272] [PUBMED]
- 71 Starker LF, Carling T. Molecular genetics of gastroenteropancreatic neuroendocrine tumors. Curr Opin Oncol. 2009 Jan;21(1):29-33. [http://www.ncbi.nlm.nih.gov/pubmed/19125015] [PUBMED]
- 72 Rocco JW, Sidransky D. p16(MTS-1/CDKN2/INK4a) in cancer progression. Exp Cell Res. 2001 Mar 10;264(1):42-55. [http://www.ncbi.nlm.nih.gov/pubmed] [PUBMED]
- 73 Johannessen CM, Reczek EE, James MF, Brems H, Legius E, Cichowski K. The NF1 tumor suppressor critically regulates TSC2 and mTOR. Proc Natl Acad Sci U S A. 2005 Jun 14;102(24):8573-8. [http://www.ncbi.nlm.nih.gov/pubmed] [PUBMED]
- 74 Gladden AB, Hebert AM, Schneeberger EE, McClatchey AI. The NF2 Tumor Suppressor, Merlin, Regulates Epidermal Development through the Establishment of a Junctional Polarity Complex. Dev Cell. 2010 Nov 16;19(5):727-39. [http://www.ncbi.nlm.nih.gov/pubmed] [PUBMED]
- 75 Giono LE, Manfredi JJ. The p53 tumor suppressor participates in multiple cell cycle checkpoints. J Cell Physiol. 2006 Oct;209(1):13-20. [http://www.ncbi.nlm.nih.gov/pubmed/16741928] [PUBMED]
- 76 Backman S, Stambolic V, Mak T. "PTEN function in mammalian cell size regulation." Curr Opin Neurobiol (2002). 12(5): 516. [PUBMED]
- 77 Yamasaki L. Role of the RB tumor suppressor in cancer. Cancer Treat Res. 2003;115:209-39. [http://www.ncbi.nlm.nih.gov/pubmed/12613199] [PUBMED]
- 78 Kaelin WG Jr. "Molecular basis of the VHL hereditary cancer syndrome." Nat Rev Cancer (2002). 2(9):673-82. [PUBMED]
- 79 Bernstein C, Bernstein H, Payne CM, Garewal H. "DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis." Mutat Res (2002). 511(2): 145-78. [PUBMED]
- 80 Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993 Dec 3;75(5):843-54. [PUBMED]
- 81 Bartel DP. MicroRNAs: target recognition and regulatory functions. Hum Mol Genet. 2005 Apr 15;14 Spec No 1:R121-32 [PUBMED]
- 82 Kusenda B, Mraz M, Mayer J, Pospisilova S. MicroRNA biogenesis, functionality and cancer relevance. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2006 Nov;150(2):205-15. [PUBMED]
- 83ab Zhang B, Pan X, Cobb GP, Anderson TA. microRNAs as oncogenes and tumor suppressors. Dev Biol. 2007 Feb 1;302(1):1-12. Epub 2006 Aug 16. [PUBMED]
- 84ab Boyd SD. Everything you wanted to know about small RNA but were afraid to ask. Lab Invest. 2008 Jun;88(6):569-78. Epub 2008 Apr 21. [PUBMED]
- 85 Nikitina EG, Urazova LN, Stegny VN. MicroRNAs and human cancer. Exp Oncol. 2012;34(1):2-8. [PUBMED]
- 86abc Schoof CR, Botelho EL, Izzotti A, Vasques Ldos R. MicroRNAs in cancer treatment and prognosis. Am J Cancer Res. 2012;2(4):414-33. Epub 2012 Jun 28. [PUBMED]
- 87abc Corsini LR, Bronte G, Terrasi M, Amodeo V, Fanale D, Fiorentino E, Cicero G, Bazan V, Russo A. The role of microRNAs in cancer: diagnostic and prognostic biomarkers and targets of therapies. Expert Opin Ther Targets. 2012 Apr;16 Suppl 2:S103-9. Epub 2012 Mar 23. [PUBMED]
- 88abc Zen K, Zhang CY. Circulating microRNAs: a novel class of biomarkers to diagnose and monitor human cancers. Med Res Rev. 2012 Mar;32(2):326-48. doi: 10.1002/med.20215. Epub 2010 Nov 9. [PUBMED]
- 89 Ross SA, Davis CD. MicroRNA, nutrition, and cancer prevention. Adv Nutr. 2011 Nov;2(6):472-85. Epub 2011 Nov 3. [PUBMED]
- 90ab Liu X, Liu L, Xu Q, Wu P, Zuo X, Ji A. MicroRNA as a novel drug target for cancer therapy. Expert Opin Biol Ther. 2012 May;12(5):573-80. Epub 2012 Mar 20. [PUBMED]
- 91 Neilson JR, Sharp PA. Small RNA regulators of gene expression. Cell. 2008 Sep 19;134(6):899-902. [PUBMED]
- 92 Dang CV. Links between metabolism and cancer. Genes Dev. 2012 May 1;26(9):877-90. [PUBMED]
- 93 Bayley JP, Devilee P. The Warburg effect in 2012. Curr Opin Oncol. 2012 Jan;24(1):62-7. [PUBMED]
- 94 Gao P, Sun L, He X, Cao Y, Zhang H. MicroRNAs and the Warburg Effect: New Players in an Old Arena. Curr Gene Ther. 2012 Aug 1;12(4):285-91. [PUBMED]
- 95 Yuxia M, Zhennan T, Wei Z. Circulating miR-125b is a novel biomarker for screening non-small-cell lung cancer and predicts poor prognosis. J Cancer Res Clin Oncol. 2012 Jul 18. [Epub ahead of print] [PUBMED]
- 96 Wang H, Tan G, Dong L, Cheng L, Li K, Wang Z, Luo H. Circulating MiR-125b as a marker predicting chemoresistance in breast cancer. PLoS One. 2012;7(4):e34210. Epub 2012 Apr 16. [PUBMED]
- 97 Cho WC. MicroRNAs as therapeutic targets and their potential applications in cancer therapy. Expert Opin Ther Targets. 2012 Aug;16(8):747-59. Epub 2012 Jun 13. [PUBMED]
- 98 Cittelly DM, Finlay-Schultz J, Howe EN, Spoelstra NS, Axlund SD, Hendricks P, Jacobsen BM, Sartorius CA, Richer JK. Progestin suppression of miR-29 potentiates dedifferentiation of breast cancer cells via KLF4. Oncogene. 2012 Jul 2. doi: 10.1038/onc.2012.275. [Epub ahead of print] [PUBMED]
- 99 Schreiber R, Mezencev R, Matyunina LV, McDonald JF. "Evidence for the role of microRNA 374b in acquired cisplatin resistance in pancreatic cancer cells." Cancer Gene Ther. 2016 May 27. [PUBMED]