
谢谢你的免疫系统,你已经有能力与你体内的癌症战斗!虽然免疫系统通常与保护我们免受病毒,细菌,和其他致病生物的侵害有关,但它实际上通过识别和杀死癌细胞,从而在我们对抗癌症方面发挥了重要作用。
免疫系统的一个主要功能是识别外来物体(病毒、细菌、寄生虫、碎片和任何不应该在你体内的东西)并摧毁它们。免疫细胞通过识别物体表面的特定目标来实现这一点。癌细胞是异常的,可能被免疫细胞识别为“外来”。免疫细胞可以杀死这些癌细胞。
本章节讨论的主题:
不幸的是,免疫系统也与癌症的发展密切相关。虽然这肯定不是对人有益的事情,但细胞并没有“思考”他们在做什么,只是真正在做他们被要求做的事情。你可以在此处了解更多信息:
为什么人们会得癌症?
免疫系统的一个主要功能是识别外来物体(病毒、细菌、寄生虫、碎片和任何不应该在你体内的东西)并摧毁它们。免疫细胞通过识别待销毁物品表面的特定目标来实现这一点。 癌细胞是异常的,可能被免疫细胞识别为“外来”。免疫细胞识别与肿瘤细胞相关的小分子标记(称为肿瘤特异性抗原(TSAs)或肿瘤相关抗原(TAAs))。免疫细胞可以杀死这些癌细胞。
注意:抗原可以定义为免疫系统能够识别的任何东西。这是一个通称。抗原可以是蛋白质、糖、脂质、核酸或混合分子。大多数抗原是蛋白质。
如果免疫系统能够识别并杀死癌细胞,为什么人们会得癌症?
据认为,大多数癌症很早就被发现,并被免疫系统消灭。存活下来的癌症必须能够逃避免疫系统。事实证明,有几种方法可以避免癌细胞被识别和杀死。这些措施包括:
- 癌细胞是由正常细胞形成的。因为癌症是由人自身的细胞产生的,所以免疫系统识别癌细胞比识别像病毒这样的真正外来入侵者要困难得多。
- 靶点最多的癌细胞最容易被免疫系统杀死。这听起来是件好事,它可以使肿瘤缩小,但过了一段时间,剩下的癌细胞表面的靶点就少了。那些表面上目标抗原含量最少的人存活的几率最大,并且往往会接管,使癌症对免疫细胞产生抵抗力。这类似于用除草剂处理草坪。任何有抗药性的杂草都能生存和生长。在那之后,除草剂将不再有效。免疫系统意外地“选择”了它无法识别的癌细胞。
- 癌细胞可以劫持正常的控制系统来关闭肿瘤内部和周围的免疫系统。 为了控制免疫系统,有几种控制装置(如“开-关”开关)用于调节免疫细胞的活动。一些癌细胞能够翻转这个开关,关闭肿瘤周围和肿瘤内的免疫系统。旨在扭转这种状况的治疗方法非常有希望,下文将对此进行详细描述。
- 癌细胞可以通过减少免疫细胞用来识别缺陷或感染细胞的“自我”信号来逃避免疫系统。癌症蛋白质可以通过粘附在旗杆的细胞版本上向免疫系统显示。通过拆除电极,癌细胞可以防止这种情况的发生,并且能够避免被识别和杀死。1, 2, 3
免疫系统-癌细胞之战
免疫系统和癌症之间的斗争是复杂的,可以持续多年。大多数癌症很可能在很早的阶段就被免疫系统消灭了,而没有任何证据表明它们的存在。只有那些能够避开免疫系统的癌症才会变得危险。
免疫系统如何杀死癌细胞?
免疫系统就像一个军事组织一样被分割开来,不同的细胞配备不同的武器来攻击不同类型的目标。
自然杀伤(NK)细胞能够识别肿瘤细胞表面的蛋白质,它们释放在靶细胞膜上打孔的蛋白质,导致细胞死亡。
其他细胞(巨噬细胞和树突状细胞)可能参与并释放细胞信号蛋白(细胞因子),以招募和“激活”T细胞。受刺激的T细胞可以直接杀死癌细胞或招募另一种免疫细胞,B细胞。B细胞产生的蛋白质(抗体)可以粘附在癌细胞的靶点上。这进一步强化了反应,并可能导致癌细胞死亡。4, 5, 6, 7
癌细胞如何关闭免疫系统?
如前所述,免疫系统是一种强大的武器。毫不奇怪,当不再需要系统时,会有控制装置关闭系统。一个“关闭开关”称为程序化死亡配体1(PD-L1)。它是一种蛋白质,通常存在于被称为巨噬细胞的免疫细胞上。PD-L1与另一种蛋白质PD-1结合,PD-1存在于T细胞表面,当这两种蛋白质相互接触时,T细胞“被告知”停止攻击。
如果癌细胞表面有PD-L1,与该细胞接触的T细胞可能会停止其防御活动。这导致癌细胞存活。
另一对蛋白质CTLA-4和B7-1发出另一个信号,告诉T细胞停止攻击癌细胞。与PD-1一样,CTLA-4也存在于T细胞表面。与PD-1/PD-L1相互作用一样,当CTLA-4与其伴侣结合时,T细胞变得不活跃。8, 9, 10
如何克服癌细胞的防御?
许多研究人员正致力于开发能“唤醒”癌症患者并激活其免疫系统的治疗方法。针对癌症患者的免疫逃避策略的药物已经产生了一些非常令人兴奋的结果,并且正在进行非常积极的研究。
刺激免疫系统的治疗分为几类。
1. 一般免疫激活
有几种蛋白质可以引起全身免疫激活。这些细胞间信号(细胞因子)提高了体内的免疫活性。它们不是针对任何特定目标或癌症的。使用这些药物治疗癌症的想法是,如果癌症活跃,免疫系统可以杀死癌症。这些信号就像让军队处于“高度戒备”状态。免疫刺激细胞因子的例子有α-干扰素(α-IFN)和白细胞介素2(IL-2)。这些蛋白质可以是人造的,并且被批准用于某些癌症的治疗。11, 12, 13, 14
2. 检查点拦截器
这些药物的作用是“启动”免疫细胞,这些免疫细胞被前面描述的一种蛋白质相互作用所关闭。
首批获得FDA批准的癌症免疫疗法之一是伊普利单抗(商标名Yervoy®)。这种药物实际上是一种抗体。抗体是非常特异性地与目标结合的蛋白质。抗体中和靶细胞,有时向其他细胞发出信号摧毁靶细胞。Yervoy通过结合并阻止CTLA-4的功能,帮助延长对癌症的免疫反应。如果CTLA-4与B7-1的结合被阻止,则可以发生更持久的免疫反应。
Yervoy®被批准用于治疗黑色素瘤,因为Yervoy®的临床研究表明它延长了黑色素瘤患者的生存期。Yervoy®目前正在进行临床研究,以测试其治疗肺癌、膀胱癌和前列腺癌的疗效。15, 16, 17
Pembrolizumab(Keytruda®)是一种抗体药物,可与PD-1结合,阻断两者之间的相互作用 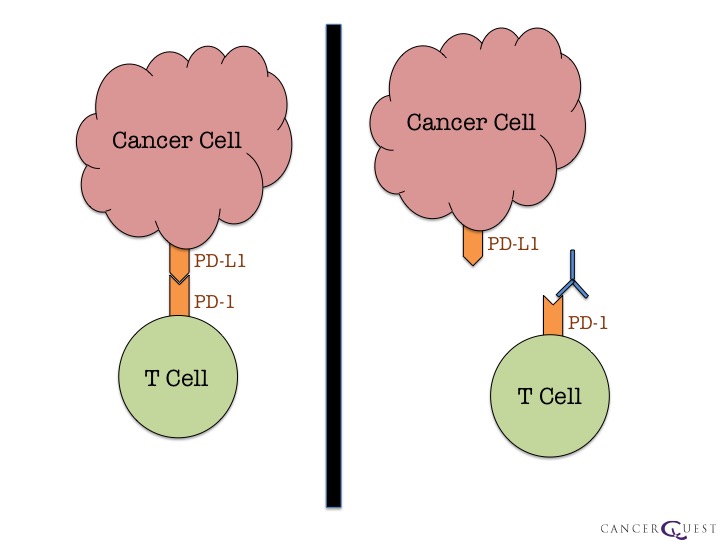
PD-1 和PD-L1。该疗法已被批准用于黑色素瘤患者18,并获得FDA的“突破疗法”指定,用于治疗某些形式的肺癌。19
另一种抗PD-1抗体nivolumab(品牌名称-Opdivo®)在美国被批准用于黑色素瘤和非小细胞肺癌。20, 21 Opdivo®的工作原理与Keytruda®类似;通过阻断PD-1/PD-L1相互作用,它允许T细胞保持活性,即使肿瘤细胞表面有PD-L1。针对其他几种癌症的测试正在进行中。22
检查是否有活性的试验. (打开一个新的窗口)
另一种抗体免疫疗法是抗PD-L1抗体MPDL3280A。该抗体与Opdivo®相似,只是它粘附在PD-1的伴侣PD-L1上。结果是一样的,激活了免疫系统。目前正在进行临床试验。
检查是否有活性的试验. (打开一个新的窗口)
右边的图像显示了癌细胞和T细胞(一种免疫系统细胞)之间的相互作用。当PD-1/PD-L1相互作用发生时,它会关闭该T细胞的活性。这限制了身体对抗癌症的能力。抗体药物,通过粘附其中一个伴侣来防止这种情况发生。图中显示了粘附在PD-1蛋白上的抗体。这就是Keytruda®和Opdivo®的工作方式。
3. 癌症疫苗
另一种方法是尝试通过使用癌细胞蛋白质刺激免疫系统来增强对癌症的免疫反应。单个蛋白质或蛋白质混合物可以用来告诉免疫细胞他们应该寻找什么。这与疫苗预防腮腺炎和麻疹等疾病的方式非常相似。
目前正在研究几种癌症疫苗的方法。这些都包含在单独的治疗部分中。
4. 嵌合抗原受体(CAR)T细胞疗法使癌症疫苗的理念更进一步。不是激活抗原呈递细胞来对抗人的癌症,而是对人的T细胞进行修饰以特异性攻击癌细胞。这是通过基因改造患者的T细胞来识别癌细胞表面的蛋白质来实现的。23, 24 结果非常令人兴奋。一项针对B细胞急性淋巴细胞白血病(ALL)的CAR T细胞临床试验产生了88%的总完全应答率。25
2017年7月12日,FDA咨询委员会一致投票建议批准对复发或耐药的急性淋巴细胞白血病(ALL)儿童和年轻人进行CAR T细胞治疗。262017年8月30日,FDA批准了癌症治疗Kymriah,这是美国第一个合法使用的基因疗法。它被批准用于治疗25岁以下患有某些类型的B细胞急性淋巴细胞白血病(ALL)的患者。27
- 1 Vinay DS, Ryan EP, Pawelec G, Talib WH, Stagg J, Elkord E, Lichtor T, Decker WK, Whelan RL, Kumara HM, Signori E, Honoki K, Georgakilas AG, Amin A, Helferich WG, Boosani CS, Guha G, Ciriolo MR, Chen S, Mohammed SI, Azmi AS, Keith WN, Bilsland A, Bhakta D, Halicka D, Fujii H, Aquilano K, Ashraf SS, Nowsheen S, Yang X, Choi BK, Kwon BS. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Semin Cancer Biol. 2015 Mar 25. pii: S1044-579X(15)00019-X [Epub ahead of print] [PUBMED]
- 2 Seliger B. Strategies of tumor immune evasion. BioDrugs. 2005;19(6):347-54. [PUBMED]
- 3 Poggi A, Musso A, Dapino I, Zocchi MR. Mechanisms of tumor escape from immune system: role of mesenchymal stromal cells. Immunol Lett. 2014 May-Jun;159(1-2):55-72. Epub 2014 Mar 20. [PUBMED]
- 4 Dunn GP, Old LJ, Schreiber RD. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 2004 Aug;21(2):137-48. [PUBMED]
- 5 Bindea G, Mlecnik B, Fridman WH, Pagès F, Galon J. Natural immunity to cancer in humans. Curr Opin Immunol. 2010 Apr;22(2):215-22. Epub 2010 Mar 6. [PUBMED]
- 6 Smyth MJ, Dunn GP, Schreiber RD. Cancer immunosurveillance and immunoediting: the roles of immunity in suppressing tumor development and shaping tumor immunogenicity. Adv Immunol. 2006;90:1-50. [PUBMED]
- 7 Bachanova V, Miller JS. NK cells in therapy of cancer. Crit Rev Oncog. 2014;19(1-2):133-41. [PUBMED]
- 8 Swaika A, Hammond WA, Joseph RW. Current state of anti-PD-L1 and anti-PD-1 agents in cancer therapy. Mol Immunol. 2015 Mar 4. pii: S0161-5890(15)00049-8. [Epub ahead of print] [PUBMED]
- 9 Zamarin D, Postow MA. Immune checkpoint modulation: rational design of combination strategies. Pharmacol Ther. 2015 Jun;150:23-32. Epub 2015 Jan 10. [PUBMED]
- 10 Pico de Coaña Y, Choudhury A, Kiessling R. Checkpoint blockade for cancer therapy: revitalizing a suppressed immune system. Trends Mol Med. 2015 Jun 16. [Epub ahead of print] [PUBMED]
- 11 Rizza P, Moretti F, Belardelli F. Recent advances on the immunomodulatory effects of IFN-alpha: implications for cancer immunotherapy and autoimmunity. Autoimmunity. 2010 Apr;43(3):204-9. [PUBMED]
- 12 Ferrantini M, Capone I, Belardelli F. Interferon-alpha and cancer: mechanisms of action and new perspectives of clinical use. Biochimie. 2007 Jun-Jul;89(6-7):884-93. Epub 2007 Apr 21. [PUBMED]
- 13 Rosenberg SA. IL-2: the first effective immunotherapy for human cancer. J Immunol. 2014 Jun 15;192(12):5451-8 [PUBMED]
- 14 Sim GC, Radvanyi L. The IL-2 cytokine family in cancer immunotherapy. Cytokine Growth Factor Rev. 2014 Aug;25(4):377-90. Epub 2014 Aug 1. [PUBMED]
- 15 Buqué A, Bloy N, Aranda F, Castoldi F, Eggermont A, Cremer I, Fridman WH, Fucikova J, Galon J, Marabelle A, Spisek R, Tartour E, Zitvogel L, Kroemer G, Galluzzi L. Trial Watch: Immunomodulatory monoclonal antibodies for oncological indications. Oncoimmunology. 2015 Mar 2;4(4):e1008814. eCollection 2015. [PUBMED]
- 16 Barbee MS, Ogunniyi A, Horvat TZ, Dang TO. Current Status and Future Directions of the Immune Checkpoint Inhibitors Ipilimumab, Pembrolizumab, and Nivolumab in Oncology. Ann Pharmacother. 2015 May 19. [Epub ahead of print] [PUBMED]
- 17 Villaruz LC, Kalyan A, Zarour H, Socinski MA. Immunotherapy in lung cancer. Transl Lung Cancer Res. 2014 Feb;3(1):2-14. [PUBMED]
- 18 FDA approves Keytruda for advanced melanoma. U.S. Food and Drug Administration website. Published September 4, 2014. Updated September 10, 2014. Accessed September 13, 2014. [http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm412802.htm.]
- 19 Merck Receives FDA Breakthrough Therapy Designation for KEYTRUDA® (pembrolizumab) in Advanced Non-Small Cell Lung Cancer 11/27/2014 [http://www.mercknewsroom.com/news-release/oncology-newsroom/merck-receives-fda-breakthrough-therapy-designation-keytruda-pembroli]
- 20 FDA approves Opdivo for advanced melanoma (FDA News Release) [http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm412802.htm]
- 21 FDA expands approved use of Opdivo to treat lung cancer (FDA News Release) [http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm436534.htm]
- 22 Clinical Trials Search Results for Opdivo® [http://www.cancer.gov/about-cancer/treatment/clinical-trials/search/results?protocolsearchid=14278803]
- 23 Chakravarti D, Wong WW. Synthetic biology in cell-based cancer immunotherapy. Trends Biotechnol. 2015 Jun 15. pii: S0167-7799(15)00110-9. [Epub ahead of print] [PUBMED]
- 24 Sharpe M, Mount N. Genetically modified T cells in cancer therapy: opportunities and challenges. Dis Model Mech. 2015 Apr;8(4):337-350. Epub 2015 Apr 1. [PUBMED]
- 25 Davila ML, Riviere I, Wang X, Bartido S, Park J, Curran K, Chung SS, Stefanski J, Borquez-Ojeda O, Olszewska M, Qu J, Wasielewska T, He Q, Fink M, Shinglot H, Youssif M, Satter M, Wang Y, Hosey J, Quintanilla H, Halton E, Bernal Y, Bouhassira DC, Arcila ME, Gonen M, Roboz GJ, Maslak P, Douer D, Frattini MG, Giralt S, Sadelain M, Brentjens R. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med. 2014 Feb 19;6(224):224ra25 [PUBMED]
- 26 Mika, Aggie. "FDA Votes Yes on CAR T-Cell Therapy." The Scientist (2017). [THE SCIENTIST]
- 27 FDA approves Kymriah for the treatment of refractory B-cell ALL in patients under 25 years of age. [https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm]
