癌癥治療中主要的失敗原因之一是癌細胞產生的抗藥性。這是壹個可以引起疾病復發甚至是死亡的嚴重問題。這部分網站的目的是介紹一些常見的癌細胞產生抗藥性的方式。任何病例裏都可能會出現不止壹種下列抗藥性機理。這張網頁包括以下信息:
更加深入地研究抗藥性: 甲氨蝶呤
理解甲氨蝶呤的作用能引導更好地理解耐藥性的產生。目前已知細胞有三種方法來獲得對這種葉酸共軛酶的免疫。
-
細胞內部降低的藥物濃度:細胞裏甲氨蝶呤的濃度可能因為負責把藥物轉移進細胞的運輸系統產生了改變而降低。如果允許甲氨蝶呤通過的渠道數量變少了,細胞內部的藥物也就會變少。不止如此,變化的新陳代謝速度也會影響藥物的濃度。當藥物被代謝時,它會變得更容易從細胞中被去除,導致濃度和活躍度降低。1
-
提高細胞內部DHFR濃度:DHFR基因的基因擴增會導致DHFR的數量增多而且被發現對於甲氨蝶呤治療的反應降低之間有著聯系。1
-
DHFR變異會導致DHFR與甲氨蝶呤的結合減少:甲氨蝶呤必須與DHFR結合才能阻止它的活動。如果基因變化導致DHFR的結合區域產生了形狀變化而影響甲氨蝶呤結合,DHFR將會繼續激活葉酸而治療的效果將會減弱。1
所有上述結果都會涉及甲氨蝶呤抗藥性的增強。後期產生的甲氨蝶呤抗藥性是藥物療法中首要的並發癥之一。2
化療藥物的抗藥性是很多治療失敗的關鍵因素之一。
耐藥細胞的選擇(概覽)
選擇對於某種特定藥物擁有耐藥性的細胞:雖然大部分的癌癥被認為是從單個前體細胞中產生的,但是把腫瘤看成是壹系列基因相同的細胞組成的卻是錯誤的看法。癌癥的特征其壹就是增加了基因的不穩定性和變異幾率。這些變化代表著分裂的癌細胞會以更快的速度得到基因變化(變異)。實際上,這意味著雖然腫瘤中的細胞十分類似,卻並非完全相同。當接觸到癌癥藥物時,對於藥效敏感的細胞會被殺死,而抗藥的細胞將會存活並繼續分裂。結果就是壹個重新生長的腫瘤且並不會對原始治癌藥物敏感。以下是最初腫瘤裏產生抗藥細胞的壹些原因。正是因為如此,再加上其他因素,化療藥物 經常組合使用。盡管單個細胞對多種藥物產生抗藥性的可能性微乎其微,尤其是那些影響不同的細胞生存途徑的藥物,腫瘤中大量的細胞數量仍然使這種可能性不容小覷。3
基因擴增
正如上列小節所提到的,癌癥藥物擁有多種運作機理。癌細胞為什麽能對這些不同的藥產生抗藥性呢?下列是壹部分常見的癌細胞逃避被化療或是其他治療方法殺死的方法。
增加靶蛋白的表達:有些抗癌藥物,比如甲氨蝶呤,其運作原理是抑制控制細胞分裂以及生長的在關鍵路徑上特定的酶。增強控制靶分子數量的基因表達(轉錄)能夠引起細胞內靶分子的數量驟增。既然細胞內部藥物的濃度被所給的劑量限制,增多的靶分子意味著很多靶分子並不會受到藥物影響。靶分子的數量對於藥物來說太多了。在下面的動畫中,您可以看到第壹種情況,所有“靶分子”(綠色)都被藥物(紅色)所綁住。在第二種情況中,靶分子的數量過多。在細胞中,這就代表著藥物的效果會減弱,甚至可能會達到無法減緩細胞生長的程度。3
靶基因的表達增強的其中壹種方法是基因擴增。這個過程包括選擇性複製一個染色體的壹個區域。這個過程可以被重復很多遍,產生很多特定區域的複製版本。基因擴增步驟顯示在以下的圖解中。左側顯示著正常的復制基因過程而右側的是部分染色體的擴增現象。
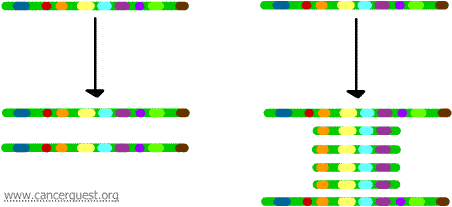
被擴增的染色體部分中的每份基因均可以被轉錄,導致那些基因編碼的蛋白 被大量制造。3 1
多重抗藥性 (MDR)
藥物無法進入細胞並/或藥物被排出:藥物有幾種不能在癌細胞中達到預期效果的原因。其中最常見的壹種問題是壹條常被稱為MDR1 (代表多重抗藥性)的基因被擴增。這個蛋白另外壹個常見的名字是P糖蛋白。這個基因編碼一個大型跨膜蛋白能夠 a) 阻止某些藥物進入細胞和 b) 在藥物進入細胞後把它排出。這些功能的組合讓MDR蛋白可以有效地降低細胞內部壹系列化療藥物的濃度。雖然這個蛋白的正常功能與化療藥物完全沒有關聯,它卻經常成為化療藥物失敗的原因。下面的動畫體現了阻止藥物進入和藥物排出的過程。1
幾種抑制這種蛋白活性的藥正在被研究的事實更加強調了MDR引起的抗藥性的重要性。4 此外,MDR也被作為基因療法來研究是否能夠在化療患者體內增強耐藥性。MDR基因被插入到骨髓幹細胞中然後重新被放回患者體內。骨髓中增強的MDR基因表達讓它們變得不再那麽容易受到藥物的負面影響並允許病人承受更高劑量的化療藥物。專家希望提高的藥物濃度能夠更加有效地消滅癌癥。5
血-腦屏障
取決於腫瘤的大小和位置,采取的治療方法有可能無法到達靶細胞。處理大型腫瘤時,中心部分可能因腫瘤內部供血不足而難以治療。治療頭顱內的腫瘤時則會遇到另壹種問題。大腦的營養供給來自於一個血管網絡。這些血管的構造方式與大部分的循環系統稍有不同,而這些血管裏的變化讓很多不同種類的分子很難穿透到包圍大腦的空間裏。限制分子穿過這些血管的運動稱作為血-腦屏障。正是因為如此,某些藥物無法治療腦腫瘤。下面展示了選擇性穿透血-腦屏障的過程。3
靶分子的轉變
靶分子不再存在:隨著癌癥的惡化,某種特定治療方案可能會失效。乳腺癌或是卵巢癌細胞中消失的雌激素受體(ER)就是壹個例子。這種變化在理論上將會大大削弱抗雌激素他莫昔芬的效果。這些細胞中雌激素受體的消失代表著細胞將不再依賴雌激素作為生長刺激素。正是因為這個原因,初始階段乳腺癌和卵巢癌診斷中會確定ER的狀態。 3
靶分子出現了改變:癌細胞中的基因突變非常常見。對於化療藥物的接觸可以殺死那些擁有普通靶分子的細胞,卻讓得到基因改變的細胞幸免於難。被輕微修改過的基因可能仍然能在細胞內部運作,但是它已經不能再被特定的藥物所抑制。以下的動畫展示了這個過程。3
以上過程的壹個例子是接受過激酶抑制藥物格列衛(Gleevec®)治療的病人體內產生的特定抗藥性。最近的研究已經確認了靶基因中特定的突變使得腫瘤蛋白具有抗藥性。6
- 1 a b c d e Bredel M, Zentner J. "Brain-tumour drug resistance: the bare essentials." Lancet Oncol (2002). 3(7): 397-406. [PUBMED]
- 2Physician's Desk Reference 2016. Medcial Economics: Thomson Healthcare.
- 3 a b c d e f Gottesman MM. "Mechanisms of cancer drug resistance." Annu Rev Med (2002). 53: 615-27. [PUBMED]
- 4Xenova Group. Tariquidar. (August 2002) [http://www.xenova.co.uk/dc_xr9576.html]
- 5Carpinteiro A, Peinert S, Ostertag W, Zander AR, Hossfeld DK, Kuhlcke K, Eckert HG, Baum C, Hegewisch-Becker S. "Genetic protection of repopulating hematopoietic cells with an improved MDR1-retrovirus allows administration of intensified chemotherapy following stem cell transplantation in mice." Int J Cancer (Apr 10 2002). 98(5):785-92. [PUBMED]
- 6Shah NP, Nicoll JM, Nagar B, Gorre ME, Paquette RL, Kuriyan J, and Sawyers CL. "Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyrosine kinase inhibitor imatinib (STI571) in chronic phase and blast crisis chronic myeloid leukemia." Cancer Cell (August, 2002). 2(2): 117-125. [PUBMED]
