胃癌在美国和其他发达国家相对少见。尽管胃癌在美国很少见,但它是全球第二大癌症相关死亡原因,也是全球第四大最常见的癌症。由于生活条件和饮食的改善,全世界大多数类型胃癌的发病率都在下降。1 2
据美国癌症协会估计,2016年将诊断出26370例胃癌。另据估计,2016年将有10730人死于胃癌。3
从Winship Cancer Institute of Emory University(埃默里大学Winship癌症研究所)了解更多关于胃癌的信息。
胃部解刨学
胃是一个囊状器官,位于食道和小肠之间。为有助于消化和储存食物。在解刨学上,胃被分成5个不同的区域:贲门、眼底、身体、胃窦和幽门(见下文)。胃也由5个不同的阻止层组成:粘膜,粘膜下层,肌层,浆膜下和浆膜。癌症侵入的层越多,其预后就越差。4
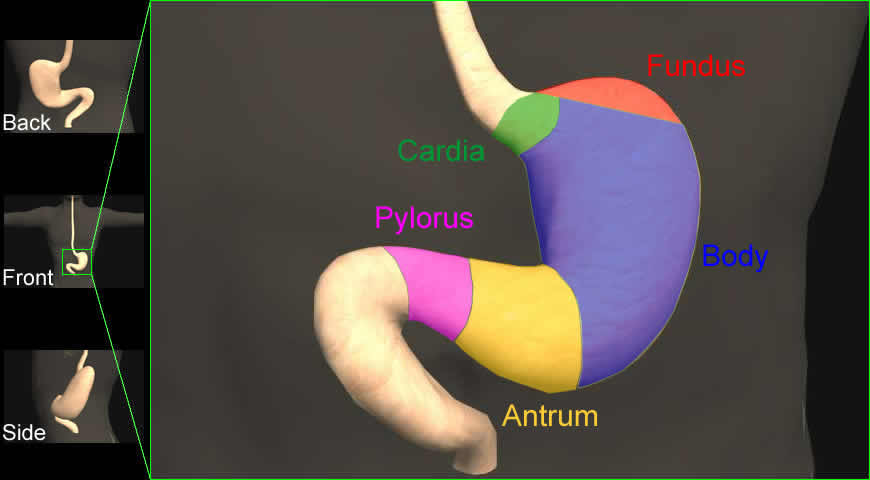
胃也与广泛的淋巴网络有关。已经扩散到附近淋巴管的癌症预后会比较差。5
胃癌:类型
下面列出了一些常见和罕见的胃癌类型:
胃腺癌 - 最常见的胃癌。它通常氛围两种亚型:肠道性的和弥漫性的。肠腺癌通常会在靠近肠道的胃部分进化,并且更频繁地影响80岁以上的人。弥漫性腺癌在年轻患者和A型血型患者中更常见。弥漫性形式是主要被认为的胃癌的形式。1 6
胃肠道质瘤 (GIST) - 罕见。来自Cajal调节肠道收缩的细胞。7
胃肠道平滑肌肉瘤 - 罕见。很少扩散到淋巴结。起源于肌层粘膜或胃壁固有层的平滑肌细胞。7
胃肠类癌 - 罕见。起源于胃体和胃底的粘膜。有着有限的转移潜能。8
胃肠道淋巴瘤- 罕见。通常在胃中进化,但可以从胃肠道的任何部位开始。9
胃癌:危险因素
影响患胃癌风险的因素:
|
|
在任何给定的癌症病例中,这些因素的相对影响都是可变的。下文将会讨论其中的一些风险因素。
幽门螺杆菌感染
幽门螺杆菌是世界上最常见的细菌感染之一。它会引起十二指肠和胃溃疡以及慢性胃炎。幽门螺杆菌感染显著增加患胃腺癌的风险。世界卫生组织将幽门螺旋杆菌归类为I类致癌物。它存在于世界一半以上人口的胃里。细菌生活在胃的粘膜内层,可引起慢性炎症(胃炎)。这种炎症可导致促进癌症发展的DNA损伤。幽门螺杆菌与70%以上的胃腺癌有关。
根除感染是预防胃癌的最佳方法。可以使用抗生素,胃酸抑制剂和胃保护剂的组合。不幸的是,根除幽门螺杆菌的充分诊断测试和药物治疗非常昂贵。疫苗将是解决幽门螺杆菌问题的更好方法。疫苗在动物模型中等程度的成功,但在人类中却没有。目前正在研究几种类型的疫苗。10
饮食
纤维,水果和蔬菜食用的增加会显著降低胃癌的风险。食用硝酸盐,精致碳水化合物(白面包,白米,含糖谷物等)和高度盐渍或腌制食品的消费会增加患胃癌的风险。10
性别
男性患胃癌的风险高于女性。对于肠道类型的癌症尤其如此。据认为,女性生殖激素如雌激素和黄体酮有助于预防胃癌的发展。11 12
年龄
40岁以后患胃癌的风险逐渐增加。弥漫型胃癌在年轻患者中更常见,而肠型在老年人中更常见。因此,年龄对肠道型胃癌的影响比弥漫型更大。11
种族和地理
高加索人患胃癌的风险最低,亚洲人后裔的风险最高。这种差异主要是由于饮食和生活条件。日本和中国的胃癌和幽门螺旋菌感染率最高。东欧的风险也高于北美,西欧和北欧。11 1
吸烟
研究表明,吸烟会增加患胃癌的风险。亚洲吸烟者患肠型胃癌的风险较高 ,而西方吸烟者患弥漫型胃癌的风险较高。11
胃癌家族史
癌症病例可为散发性和家族性两大类。散发性癌症是那些受影响的个体没有已知的疾病家族史的癌症患者。家族性癌症往往发生在一个家庭的几代人中,受影响的通常有近亲(兄弟,姐妹,父亲)患有相同类型的癌症。这些个体可能遗传特定癌症发展风险的基因。具有癌症家族史的个体患该疾病的风险增加。风险的增加取决于受影响的相对类型。与患有胃癌的人的关系越密切,他们就越有可能共享相关基因。遗传性胃癌约占所有胃癌病例的1~3%.13 .
主要的胃癌易感综合症称为遗传性弥漫性胃癌(HDGC)。消化系统癌症的其他遗传形式包括家族性腺瘤性息肉病(FAP)和遗传性非息肉病性结直肠癌(HNPCC):
- 遗传性弥漫型胃癌(HDGC): HDGC是一种常染色体显性遗传疾病,由CDH1基因突变引起。该突变导致1型E-钙粘蛋白减少。这种减少的表达似乎是弥漫性和肠胃癌之间的差异。对于这些人,从16-82岁开始,癌症的发作变化很大。该综合症可进行基因检测。14 了解更多关于FAP 和HNPCC.
胃癌:症状
症状
早期胃癌一般症状很少,但可能出现以下症状:15
- 消化不良,胃部不适或胃灼热
- 恶心或食欲不振
- 感到疲倦
晚期胃癌与以下症状相关:15
- 粪便中的血迹呈黑色
- 吃了东西后,即使吃了少量的东西,也会有涨大的感觉
- 饭后呕吐
- 意外的的减重
- 胃痛,尤其是饭后
- 虚弱和疲劳
胃癌的检测与诊断
诊断
在美国,胃癌在发展成晚期癌症后最常被发现。因为胃癌在美国并不常见,普通民众的筛查也不积极追捧。相比之下,像日本这样的胃癌高发国家有更严格的筛查程序。这往往导致癌症在早起被发现。16
由于约1%的幽门螺杆菌感染者会患胃癌,有人建议,在美国,对感染率高的地区的人进行这种细菌感染的筛查。17
有关检测癌症的方法的信息,请参阅诊断和检测部分。
胃癌的病理及分期
病理报告
如果怀疑病人可能患有胃癌,可以取组织样本(活检)进行检查。活检后,进行活检的医生将标本送至病理学家。病理学家检查标本利用宏观(肉眼可见)和显微镜(需要放大),向医生发送病理报告。报告包含了有关组织外观、细胞组成、疾病状态或正常状态的信息。
查看有关病例报告的更多信息。
分期
癌症分期是描述疾病程度的一种方法。肿瘤分期最常用的方法之一是T/N/M系统。这个系统根据癌症在体内的大小、位置和扩散程度来分配严重程度。影响胃癌患者生存率的两个重要因素是胃壁侵润深度和受累淋巴结数目。15
进一步了解癌症分期和TNM系统。
胃癌:肿瘤生物学与遗传学
关键基因的突变(或表观遗传修饰)改变了细胞的行为。基因的改变导致蛋白质产物的变化和基因产生的产物量的变化(基因表达)。随着变化的积累,细胞变的更不正常,癌症也在发展。关于这些变化的细节可以在突变部分找到。 以下列出并讨论了一些在癌症发生过程中起重要作用的基因:
- CDH1 基因
- TP53 基因
- APC 基因
CDH1 基因
CDH1编织一种叫做上皮钙粘蛋白或E-钙粘蛋白的蛋白质。这种蛋白质参与细胞与细胞的粘附,并负责组织的形成。钙粘蛋白在细胞信号传导、细胞运动和基因调节中也有作用。CDH1是肿瘤抑制基因。遗传性CDH1突变与遗传性弥漫性胃癌(HDGC)综合症有关。这种基因的突变也会增加患小叶性乳腺癌和前列腺癌的风险。 18
19
TP53基因
TP53是一种肿瘤抑制基因,它可以编制蛋白产物p53。据报道,TP53在80%的胃癌中受损(突变)或丢失。18
APC基因
腺癌(APC)是一种肿瘤抑制基因。APC基因在结直肠癌发展中的作用是众所周知的。然而60%的肠型胃癌和25%的胃癌中发现了该基因的突变。18
胃癌:治疗
胃癌的治疗根据肿瘤的不同分为早期和晚期两大类。早期治疗包括尚未穿透胃浆膜层的肿瘤。晚期治疗包括穿透浆膜并扩散到身体其他部位的肿瘤。治疗方案取决于肿瘤的大小和位置、患者的身体状况和癌症分期。
手术是早期胃癌最常见的治疗方法。胃癌有三种主要的手术选择:
- 全胃切除术- 手术切除整个胃
- 部分或大部位切除术 - 切除胃特定部分的手术
- 切除术 - 切除肿瘤和周围组织的手术
在任何类型的手术中,切除周围淋巴结是经常的。化疗和放疗也可以在确定后使用。胃癌的复发率很高,因此保持健康的生活方式和治疗后的持续医疗监护是非常重要的。
因为我们的重点是癌症的生物学和治疗,所以我们没有给出详细的治疗指南。相反,我们提供了美国制定治疗指南的链接。
国家综合癌症网络(NCCN) 列出了以下胃癌治疗方法:
临床试验信息
- CancerQuest的一般临床试验信息
- 点击这里了解Winship Cancer Institute of Emory University (埃默里大学Winship癌症研究所)的临床试验信息
- 点击这里获取National Cancer Institute(国家癌症研究所)的临床试验信息。
- 点击这里获取Georgia Clinical Trials Online(乔治亚州临床试验在线)的临床试验信息
胃癌资源
胃癌风险
胃癌风险因素(Moffitt Cancer Center 莫非特癌症中心)
胃癌的检测与诊断
Winship Cancer Institute(Winship癌症研究所): 预约
胃癌治疗
胃癌生存率
胃癌幸存者的长期风险
国际胃癌资资(International Gastric Cancer Resources)
英国癌症研究所(Cancer Research UK):胃癌
小结:胃癌
介绍
- 胃癌是全球第二大癌症相关的死亡原因。
- 胃癌在美国很少见。
- 胃腺癌是最常见的一种胃癌。
风险因素
- 幽门螺杆菌和饮食是两个最重要的危险因素。
- 男性比女性面临更大的危险。
- 遗传基因会增加胃癌发生的风险。遗传性弥漫性胃癌(HDGC)综合症涉及遗传特定形式的CDH1基因。
症状
- 早期胃癌通常是无症状的。
- 晚期胃癌可引起腹痛、便血或体重减轻。
病例报告及分期
- 组织活检可以检查组织外观、组织组成和异常。
- T/N/M系统是胃癌分期最常用的方法之一。
- T/N/M 系统根据癌症的大小、位置和扩散程度来分配严重程度。
肿瘤生物学
- 癌症中会发生许多基因变化。 细节可以在突变部分找到。
- 遗传性胃癌中较常见的一种突变发生在CDH1基因中,CDH1基因作为肿瘤抑制因子,在细胞信号传导中发生作用。
治疗
- 治疗包括手术、放疗和化疗。
- 胃周围的淋巴结在手术中常被切除。
从Winship癌症研究所了解更多关于胃癌的信息。
- 1 a b c Hohenberger P, Gretschel S. "Gastric cancer." Lancet. 2003 Jul 26;362(9380):305-15. [PUBMED]
- 2World Health Organization. "Global cancer rates could increase by 50% to 15 million by 2020." Switzerland. 3 April 2003. [http://www.who.int/mediacentre/news/releases/2003/pr27/en/]
- 3American Cancer Society. Cancer Facts & Figures 2016. Atlanta: American Cancer Society; 2016. [http://www.cancer.org/acs/groups/content/@research/documents/document/acspc-047079.pdf]
- 4Vander, Arthur J., James H. Sherman, Dorothy S. Luciano. Human Physiology, 6th Edition. McGraw-Hill, Inc. NY, NY (1994).
- 5Detailed guide to stomach cancer. American Cancer Society (accessed August 2010). [http://www.cancer.org/Cancer/StomachCancer/DetailedGuide/index]
- 6You WC, Ma JL, Liu W, Gail MH, Chang YS, Zhang L, Hu YR, Fraumeni JF Jr, Xu GW. "Blood type and family cancer history in relation to precancerous gastric lesions." Int J Epidemiol. 2000 Jun;29(3):405-7. [PUBMED]
- 7 a b Katz SC, DeMatteo RP. "Gastrointestinal stromal tumors and leiomyosarcomas." J Surg Oncol. 2008 Mar 15;97(4):350-9. [PUBMED]
- 8Levy AD, Sobin LH. "From the archives of the AFIP: Gastrointestinal carcinoids: imaging features with clinicopathologic comparison." Radiographics. 2007 Jan-Feb;27(1):237-57. [PUBMED]
- 9Ghai S, Pattison J, Ghai S, O'Malley ME, Khalili K, Stephens M. "Primary gastrointestinal lymphoma: spectrum of imaging findings with pathologic correlation." Radiographics. 2007 Sep-Oct;27(5):1371-88. [PUBMED]
- 10 a b Rocco A, Nardone G. "Diet, H pylori infection and gastric cancer: evidence and controversies." World J Gastroenterol. 2007 Jun 7;13(21):2901-12. [PUBMED]
- 11 a b c d Yoshida S, Kozu T, Gotoda T, Saito D. "Detection and treatment of early cancer in high-risk populations." Best Pract Res Clin Gastroenterol. 2006;20(4):745-65. [PUBMED]
- 12Freedman ND, Chow WH, Gao YT, Shu XO, Ji BT, Yang G, Lubin JH, Li HL, Rothman N, Zheng W, Abnet CC. "Menstrual and reproductive factors and gastric cancer risk in a large prospective study of women." Gut. 2007 Dec;56(12):1671-7. [PUBMED]
- 13Carneiro F, Oliveira C, Suriano G, Seruca R. "Molecular pathology of familial gastric cancer, with an emphasis on hereditary diffuse gastric cancer." J Clin Pathol. 2008 Jan;61(1):25-30. [PUBMED]
- 14Lynch HT, Kaurah P, Wirtzfeld D, Rubinstein WS, Weissman S, Lynch JF, Grady W, Wiyrick S, Senz J, Huntsman DG. "Hereditary diffuse gastric cancer: diagnosis, genetic counseling, and prophylactic total gastrectomy."Cancer. 2008 Jun 15;112(12):2655-63. [PUBMED]
- 15 a b c Layke JC, Lopez PP. "Gastric cancer: diagnosis and treatment options." Am Fam Physician. 2004 Mar 1;69(5):1133-40. [PUBMED]
- 16Graham DY, Asaka M. (2010) Eradication of gastric cancer and more efficient gastric cancer surveillance in Japan: two peas in a pod.J Gastroenterol. 45(1):1-8. Epub 2009 Aug 28. [PUBMED]
- 17Tepes, B. (2009) Can gastric cancer be prevented?J Physiol Pharmacol. Dec;60 Suppl 7:71-7. [PUBMED]
- 18 a b c Zheng L, Wang L, Ajani J, Xie K. "Molecular basis of gastric cancer development and progression." Gastric Cancer. 2004;7(2):61-77. Review. [PUBMED]
- 19Graziano F, Humar B, Guilford P. "The role of the E-cadherin gene (CDH1) in diffuse gastric cancer susceptibility: from the laboratory to clinical practice." Ann Oncol. 2003 Dec;14(12):1705-13. Review. [PUBMED]
