因为每种癌症的起源,构成,和对药物的敏感度不一,我们很难找到有效的癌症预防方法。一种可以预防癌症的活动或者是食品很难被确定,因为癌症预防的目标是造成完全不变的后果(癌症不会发生)。除此之外,因为单一的事件往往很少能导致癌症的预防,预防方法必须在执行多年之后才能给出能被分析的结果。就算有什么东西表明可以预防某种癌症,按照特定的方法活动或是饮食也不能确保癌症一定不会发展。
很多关于癌症预防的证据并不是决定性的。比如说,低脂肪1 2 高纤维3 4 和含有大量蔬果5 6 的饮食已经显示可以降低某些癌症的发病率。还有一些研究显示这种饮食和减少的癌症病例之间没有联系7 8 9 。在某些研究中,锻炼会导致减少癌症的发生;在其他研究中,锻炼并没有造成任何改变10 11 。
尽管证据间出现了冲突,美国国家癌症研究所仍然认为预防癌症最好的方法是健身,采用低卡路里并含有纤维,水果,和蔬菜的饮食。他们还建议人们应该避免久坐,动物脂肪,和烤肉来减少产生癌症的风险12 。研究显示必要营养的组合比摄入大量单一食物的效果要好。13
另外一种帮助预防癌症的方法是避免普遍被认为会增加癌症风险的行为。一些与癌症发展有联系的行为是烟草使用14 15 16 ,饮酒17 18 ,肥胖17 19 20 ,和暴露在阳光下。21 22 一项对于瑞典家庭的研究显示提高的癌症发病率与环境条件、饮食和锻炼的联系比跟遗传的联系更加紧密。23 美国癌症协会提出三分之一的美国癌症死亡与糟糕的饮食和缺乏锻炼有关。此外,另外三分之一的全球癌症死亡病例可以通过避免使用烟草而避免。24 世界卫生组织认为全球40%的癌症死亡可以被合适的饮食,锻炼,和避免烟草使用来避免。25
查看一部美国癌症协会在2015-2016发布的癌症预防数据。
除了这些笼统准则以外,还有一些特定的化合物展示出了它们可能能对癌症预防做出贡献的证据。26
以下几种预防癌症的方法将会有更加详细的描述。
如果您认为提供的信息有用,请考虑使用我们网站的链接。
运动和癌症的风险
运动指的是使用骨骼肌来消耗比仅仅呆在原地更多的能量。27
运动有很多种形式,从每天散步到举重都属于运动的范畴内。大多数国际指标建议健康的成年人每周进行150分钟的中等到高强度的运动。运动在一周之内均匀分布更佳。研究显示更经常运动会带来多种多样的健康益处。28
运动可以在人身体里引起多种变化。变化的种类取决于运动的类型和量。运动会增加心脏泵出的血液量(叫做心输出量)。这将会引起增高的氧气和血液循环。提升的心率也会触发荷尔蒙的分泌。肾上腺,负责分泌肾上腺素和去甲肾上腺素的腺体,会被激活。运动会导致暂时的乳糖增多(肌肉在化解糖分时会产生它),血压升高,血糖水平升高,和增强的免疫功能。运动还能加快新陈代谢和糖分消耗。综上所述,运动的结果被认为会降低癌症风险。29
运动与在七个区域的癌症发病率降低有着紧密的联系:膀胱,结肠,乳腺,子宫,肺,食管,肾脏,和胃。运动也与降低胰腺和子宫癌的发病率有着联系。30
运动和特定癌症种类之间的链接例子如下:
膀胱癌
运动与降低膀胱癌的风险有联系,不过两者之间的关系必须用更多外界因素的研究来确认。31
乳腺癌
在有乳腺癌的家庭史的女性中,长期日常锻炼的人们有着更低的患上绝经后乳腺癌的风险。运动对于绝经后乳腺癌的风险的影响现在仍在研究。32
结肠癌
数据显示运动可以降低结肠癌的风险,尤其是在超重或是肥胖的人群中。33
子宫癌
尽管需要更多的研究来调查风险降低的几率和特定的运动种类,中等强度的锻炼与降低的子宫癌风险之间有着关联。34
食管癌
尽管已有研究显示运动能提供对于食管和胃癌的保护,仍需要更多研究来评估能够得到好处的运动强度。35
肾癌
一项较老的2013的关于先前研究的审查得出了运动可以降低22%的肾癌发病率的结论。决定能够降低肾癌发病率的运动强度,频率,和时间长度的研究仍在进行。36
尽管运动和降低的癌症风险之间的联系已经明确,我们对于运动如何降低癌症风险的理解仍然不够全面。到目前为止,研究成果中大多显示了对于癌症发展必不可少的生物反应中的改变。就像提高的胆固醇是可能引起心脏疾病的信号一样,一系列“生化标志物”被发现造成了运动和降低的癌症风险之间的联系。37
雌激素是一种能够维持女性生殖系统的雌性性激素。虽然雌激素对于女性的身体是不可或缺的,但是过高的雌激素和其他性激素(雄激素)水平会导致女性患乳腺癌的风险更大。研究显示次数足够频繁而强度足够的锻炼可以大幅降低这些激素的水平。38
胰岛素抗性会导致血胰岛素和血糖水平提高。胰岛素会因为激活细胞增殖(细胞的快速分裂)或是抑制细胞凋亡(程序性细胞死亡)而提高肿瘤发育的可能性。39 大多数研究锻炼对癌症恶化的作用的调查专注于癌症与循环代谢因素的关系,尤其是胰岛素和糖分。运动显示能够在癌症患者体内降低胰岛素水平。40 41
锻炼会减少炎症并调节胰岛素水平42
在一项测量运动量,类型,运动的强度,以及肥胖和饮食的研究中,学者们发现有氧运动和抗阻训练的组合与癌症生化标志物的减少之间有着联系。43
炎症的生化标志物包含C反应蛋白(CRP),一种在发炎过程中会在血液里提升浓度的蛋白,和调节免疫系统的蛋白白介素-6(IL-6)和肿瘤坏死因子-α(TNFα)。
升高的胰岛素水平的生化标志物包括C肽,一种胰岛素生成的副产品。胰岛素抗性的标志包括提高的甘油三酯(TG)和降低的高密度脂蛋白胆固醇(TG/HDL) 比例和脂联素水平。降低的脂联素水平会在患与肥胖有关的疾病中起到一定的作用。
锻炼和有益的生化标志物含量有关。数据显示中等强度的锻炼会更加有效。结合有氧运动和对抗练习的运动比高强度运动或者是单一的有氧运动的效果要更加显著。
文章的作者发现运动在脂肪含量不同和饮食不同的人群中有着类似的效果,不过三项指标全较高的情况下会得到最好的结果。运动会减少肥胖,而这对于在胰岛素反应中代表炎症的生化标记物之间的关系来说是不可或缺的。
健身会促进自然杀伤(NK)细胞的激活。这些细胞拥有辨识并杀死其他细胞的能力,而癌细胞也被包含在内。提升的儿茶酚胺含量,一种在锻炼过程中被分泌的激素,会让血液里NK细胞的数量增加。
人类的NK细胞是有效的癌症杀手。使用锻炼来激活这些细胞在癌症治疗中起到了独特的作用。研究显示锻炼能够提高免疫系统对于肿瘤的反应力,而这些活动还可以被免疫检查点抑制剂再度增强。44
核糖核酸(RNA)是细胞中主要的信息传送方法之一。尽管脱氧核糖核酸(DNA)作为我们基因信息的“储存”形式存在,核糖核酸却是“工作”的形式。被称为微小核糖核酸的短RNA链管理着很多生物过程中的运作。每周的锻炼被发现会改变血液中不同的miRNA的含量。来自于锻炼的人的血浆在实验室中会降低乳腺癌细胞的存活率,而研究者把这种效果归功于样本里的微小核糖核酸。45
自由基是细胞产出的小型化学物质。它们可能会在细胞从食物中获取能量时形成,遭受辐射,或者是其他的生成方法。它们很易反应又容易与其他物质结合——并损害——细胞中很多重要的部分。细胞中很多重要的自由基来自于氧气,所以他们又被称为氧自由基。
癌症的发展可以被基因突变和自由基引起的其他细胞内部的损害所驱动。骨骼肌肉(RONS)中会产生反应的氧和氮自由基含量会因为中到高强度的锻炼而提高。与此同时,提高的水平会激活能够抑制或摧毁自由基的基因和蛋白。毁灭自由基的能力的提升能够抑制或是杀掉癌细胞。锻炼与放疗和/或化疗的结合可能会造成额外的效果,让疗法能更加有效地杀死癌细胞。46
骨骼肌肉被认为在利用锻炼来抵抗癌症的过程中起到必须的作用。骨骼肌肉会生产信号分子(细胞因子)和生长因子。这些因子可以通过血液移动并影响到全身。一些肌肉产物可以抑制肿瘤细胞。它们管制抑制细胞繁殖的蛋白的生产,改变氧自由基的水平并导致信号miRNA进入血液循环。
有氧运动和对抗训练的组合对于癌症患者和幸存者都会产生最好的效果。
研究锻炼和癌症之间的关系的实验很难设计。正是因为如此,实验结果并不统一。我们很难找到运动降低癌症风险的准确方法。测量运动和癌症的研究大多依赖自主报告的锻炼;这些是主观的并且缺乏可信度和有效性。尽管这些限制的存在,我们对于癌症风险和锻炼的联系的知识仍在进步。47
人种,血统,和性别都会影响成年人的运动类型。财力不足可能会导致儿童的身体状况不理想,同时提高患慢性疾病的几率和住院时间。经济状况也会影响受教育程度。儿童时期的不健康会影响到经济状况和健康在后代之中的转递。33.8%的白人成人,23.8%的西裔成人,和23.2%的黑人成人会有规律地参加休闲的运动。与工作无关的运动在非裔,西裔,和其他少数族裔中大幅较少,而这种差异可以在某种程度上被受教育水平,社会经济状况,和人们居住的地区所导致。在这些族群中,与工作有关的体育活动(蓝领劳动),明显超过了与工作无关的休闲运动。缺乏与工作无关的体育运动减少了运动所带来的益处,其中包括癌症的预防。48
乳腺癌患者当中就有这种状况的例子。在一项包含1735乳腺癌患者的研究中,非裔美国患者达到推荐的运动量的可能性较小。49
抗氧化物和癌症
抗氧化物在一系列病症的预防和治疗中可能会起到的作用已经是众所周知的。对于某些疾病来说,抗氧化物可能确实起到很重要的作用。不过很遗憾,其中一部分宣传并没有科学证据的支撑。为了了解抗氧化物如何运作,我们首先要理解氧化的过程。
什么是氧化?
氧化是一种化学反应。氧化就是金属生锈和苹果会变成棕色的原因。当同样的反应在您的身体里发生时,它可能会损坏细胞和组织。自由基是小型的会导致氧化损伤的化学物质。自由基可以存在于(或是因这些条件而产生)一系列物质类似于烟草烟雾,辐射(比如说阳光或者x-光)或者甚至是正常的人体运作。自由基是不稳定的并且可以与其他分子发生反应或是导致改变。自由基的靶分子包括DNA,类脂和蛋白质。当自由基与其他分子发生化学反应时,它们可能会引起一些变化(称作氧化)并阻碍靶分子正常的功能。受影响的细胞部件以及改变后的运作可能会给细胞带来严重的问题并最终转向全身。您可以在本页的深入了解部分找到更多关于氧化的信息。
什么是抗氧化物?
抗氧化物,顾名思义,就是防止或能颠倒氧化反应的化学物质。饮食中的抗氧化物包含维他命C和E。抗氧化物能够在体外实验环境中与自由基产生反应以及中和它们50
51
、在动物中改善健康并延长寿命52
53
。而很多研究正在调查这些化学物质在人类体内预防癌症的可能性。抗氧化物对人类很重要,因为它们能在“被激化的” 分子造成损伤之前就停止它们。呈现出抗氧化特征的化学物质会施放一个电子给自由基而不用从其他物质上来获得点子。与其他物质不同的是,抗氧化物无论是否含有那个施放的电子都处于稳定的状态。有些抗氧化物会以“自杀”性行为运作,与自由基形成永久键来中和它们。
抗氧化物的作用和来源
市面上有很多好的抗氧化物来源,比如说绿茶,莓果,西红柿和大豆。很多蔬菜和水果中都含有抗氧化物,因为植物会产生抗氧化物来保护自己不受阳光辐射产生的自由基的孙涵。人体会自然产生一些能够帮助保护来自于自由基的伤害的抗氧化物。很遗憾,这些并不能完全保护人体。人类必须从其他来源摄取抗氧化物来降低患上升高的自由基引起的疾病的几率54
。在身体之外,抗氧化物也有很多实用的用法:博物馆负责人会用它们来保存由生物制成的艺术品,它们可以防止食物腐烂,还可以被用来制作更好的橡胶,塑料,机动车燃料和颜料55
。
注意:只是因为一样东西是健康的并不代表越多越好。就算是最健康的物质在大量摄入的情况下也可能会引起损伤。 事实上,近期有一些证据建立了抗氧化物和癌症恶化之间的连接。抗氧化物的益处并不只限于健康的细胞;证据显示它们也能帮助癌细胞的存活和发展。在一项研究中,老鼠被打入了一种抗糖尿病的药物,而这种药物在它们的细胞中会激活一种叫做NRF2的蛋白。这种蛋白会提高细胞内部抗氧化物的水平。NRF2的激活显然能够在已经拥有肿瘤的老鼠体内提高细胞转移和肿瘤转移。切记要告诉您的医师关于任何您在服用的药物,并且在开始使用补充物之前询问医嘱。 56
观看完整的与泌尿科医生Dr. John Petros的采访。
深入了解自由基
原子由原子核,其中包含着名为质子和中子的粒子,和一系列永远像卫星绕着地球运转般绕着原子核的粒子(电子)构成。在绝大多数分子中,电子成双成对地围绕着原子核移动。自由基是个例外。在自由基中至少有一个原子有一个(未配对的)电子环绕原子核。这个单一的电子给原子一个电荷,使它非常吸引其他分子。含有为配对电子的分子本称为“激进分子”。这些自由基可以迅速与其他分子产生反应。因此,这些化合物也被称为活性物种。氧是人体内最常见的活性物质,当它获得一个额外的电子时,被称为活性氧(ROS)。
自由基从附近的分子那里“偷取”电子好让所有的电子都配上对。受影响的靶分子则会变成自由基。在细胞内部可能会出现一系列电子偷取的连环反应。自由基也可以影响细胞里几乎所有的组织,而这其中包含DNA。如果自由基从DNA上偷取电子,遗传密码和细胞运作都可能会被破坏。自由基引起的DNA损坏被发现与衰老,类风湿关节炎,炎性肠病,急性呼吸窘迫综合征(ARDS),肺气肿,和某些种类的癌症。 57 55 58
植物产物 (植物化学物) 和癌症
植物化学物是在植物中发现的化合物。下列植物化学物正在被研究其对人类健康的益处和它们所来自于的植物。在近些年间,有大量的研究在调查某些自然成分抵抗或是预防癌症恶的能力。下面的列表并不完整,现在正在被研究的化学物质还有很多种。我们选择了一些被最深入研究和知名度最高的化学品。
点击以下的链接会把您带到我们 综合肿瘤学 部分。
部分的植物产物页面。
药物
被用来预防癌症的药物受到政府严格的管制以此来保证质量和安全性。大多数医生所建议的预防癌症的药物是针对对某种癌症有着巨大风险的特定人群。这些药物并不提倡给所有人使用,因为它们可能会带来其他的健康问题,而这对于获取癌症保护来说是不值得的。尽管如此,有些已经被确认能够降低癌症风险的药物已经被美国食品药品监督管理局所批准使用。这些包含非甾体抗炎药(NSAIDS)和荷尔蒙抑制剂他莫昔芬和雷洛昔芬,以下将会进行更详细的解说。
非甾体抗炎药(NSAIDS)
NSAID 的类型
COX-1 抑制剂:

乙酰氨基酚的结构 双氯芬酸钠的结构 
布洛芬的结构 水杨酸的结构
COX-2 抑制剂:

塞来昔布的结构 荼普生的结构
罗非昔布的结构 瓦德昔布的结构
简介和背景
炎症应答是人体内免疫系统的一项正常功能。这个过程能够帮助身体在受伤后修复。当您受到割伤或是任何伤口时,受伤部位通常会发红,发热,并且肿起。这其中有一部分是被修复受损部位的免疫系统所导致的。这种应答反应把富有营养的血液带到受伤区域好让被破坏的组织被维修而让新的细胞可以生长59
。 尽管它平常有益的效果,研究显示炎症应答对于控制癌细胞生长的环境也很重要。发炎可以促进肿瘤血管生成,发病,生长以及转移。免疫系统的细胞,类似于巨噬细胞,也有可能会被炎症阻碍 60
61
62
63
。而且,免疫系统促进生长和分裂的细胞也有可能会在缺乏管理的情况下出现故障;这种行为可能会引起癌变组织生长的开始64
。
非甾体抗炎药会影响一系列叫做环氧化酶(COX)的作用。环氧化酶抑制剂会防止酶释放引起发炎,疼痛,和可能导致肿瘤生长的化学信号65 。 市面上有两种非甾体抗炎药,根据它们会抑制的环氧化酶(COX)分组 (COX-1 or COX-2)。非甾体抗炎药相当常见而且普遍会被用于止痛药 [乙酰氨基酚 (泰诺 Tylenol®), 双氯芬酸钠 (扶他林 Voltaren®), 布洛芬 (艾德维尔Advil® ), 水杨酸 (阿司匹林 Aspirin®), 塞莱希布 (西乐葆 Celebrex®),荼普生naproxen (荼普生钠 Aleve®), 罗非昔布 (万络 Vioxx®), 和瓦德昔布 (Bextra®)]。 阿司匹林也被应用于心脏病的预防。对于这种用法来说,普遍,最安全,并且医生通常建议阿司匹林的计量是81毫克/天66 。
科学研究
研究显示非甾体抗炎药是有效的化学抗癌药剂,但是同时也发现了严重的副作用。长期使用阿司匹林能够降低人类患上结直肠癌或是结直肠癌复发的风险67
68
65
69
70
71
72
。这些药物具体如何能降低癌症的风险仍然不明显,但是似乎与它们抑制环氧化酶(COX)的能力有关。73
COX-1 抑制剂会引起消化问题,例如大出血和溃疡。66
COX-2 抑制剂近期被重新审查,因为它们被发现会增加心脏病和中风的风险74 。因为与非甾体抗炎药的种种风险,只有癌症发病的高风险人群会被给与这些药来作为预防措施。研究者正在努力辨别应该使用非甾体抗炎药来降低结肠癌风险的亚群体。75
阿司匹林,一种非甾体抗炎药,有着降低某些癌症发病风险的记录,特别是结直肠癌,和食道,胃,乳腺,卵巢,和肺癌的可能。阿司匹林也会降低巴雷特食管,食管癌前兆的风险。76 尽管每天服用阿司匹林显示能够降低癌症的死亡率,77 阿司匹林仍然是一种药物,长期使用可能会引起其他问题。阿司匹林也被提议能够增加肾癌的风险。78
研究显示结直肠癌高危人群可能能用阿司匹林来降低结肠内腺瘤或是重度腺瘤的复发可能性79 。不过,它预防的效果取决于用药时长和剂量大小。80 81 长期使用阿司匹林有降低结直肠癌发病的记录。长期服用甚至会降低反常的癌症基因的甲基化。 82 相比之下,小剂量而时间短的研究没有得到这些结果。83 84 不过,美国预防服务工作队做出了结论,那就是总体来说使用阿司匹林来降低结直肠癌风险对于有着普通结直肠癌风险的人来说弊大于利。85 我们还需要更多的研究来确认对于结直肠癌高危人群来说是否利大于弊。总的来说,阿司匹林显示能够降低得结直肠癌和腺瘤的风险,并且降低有着结直肠癌病史的人癌症和腺瘤复发的可能性。尽管如此,服用阿司匹林来预防结直肠癌取决于个体患癌症的风险;阿司匹林可能带来的副作用也应该与其化学预防的能力一同被纳入考虑。
阿司匹林降低前列腺癌风险的能力在各项研究中并不统一。86 有些研究显示阿司匹林可能能够在有着潜在癌症的人群中降低前列腺抗原(PSA)的水平而影响前列腺癌的检测。87 其他研究则显示,像结直肠癌一样,阿司匹林使用的剂量和时长可能能够影响其保护作用88 。比如,研究者发现使用典型的至少80毫克的剂量并持续八年导致了前列腺癌风险降低18%。不过,在七年的按时阿司匹林服用的一年后并没有发现任何保护租用。
目前仍然无法确定阿司匹林是否能减少乳腺癌的风险。部分研究发现阿司匹林的使用与降低的乳腺癌风险有联系89 ,但是其他的发现阿司匹林的使用没有明显地降低风险88 。有可能对于不同的乳腺癌的效果不一样。例如,每日的阿司匹林使用被发现能够减少雌激素受体阳性的乳腺癌的风险88 。近期的研究也显示阿司匹林可能能够预防乳腺癌的转移 90 。
低剂量的阿司匹林可能能够帮助降低卵巢癌的风险,也有可能提高卵巢癌患者的生存率。在参考了13项不同的研究,总共包含了750,000例案例,研究者发现每日服用阿司匹林把卵巢癌的风险降低了10%。91 另外一项研究,使用着护士的健康研究的数据,发现每天使用阿司匹林的患者有了高达30%的生存率增高。92
一项大型的临床试验,阿司匹林在老年人病症预防中的效果(ASPREE) 研究了每天小剂量(100毫克)的阿司匹林对于老年人群健康状况的影响。研究追踪了超过19,000名美国和澳大利亚的年龄超过70岁的老人(美国少数族裔的参加者年龄为65+)。参与者被追踪的中位时间是4.7年。研究没有发现统计上显著的癌症病例,但是使用阿司匹林的人群更容易患上晚期癌症(已经扩散的癌症)。服用阿司匹林也与某些癌症患者更多的死亡有关。这些结果显示也许阿司匹林对老人的影响与对年轻人的效果不一样。 93
美国食物和药品管理局批准
塞莱希布 (Celebrex®) 是唯一被批准用来治疗癌症的非甾体抗炎药。它被用来在拥有一种罕见的基因疾病(腺瘤样息肉病)的人群中减少息肉数量94
。在2007年,美国预防医学工作组建议不要使用阿司匹林预防结直肠癌。95
2013年的建议也是一样的。96
激素抑制剂

药物:
他莫昔芬- Nolvadex®
雷洛昔芬- Evista®, 雷洛昔芬盐酸盐, 盐酸雷洛昔芬
被分类为:
激素抑制剂

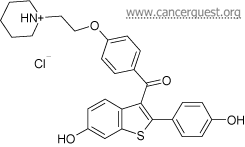
他莫昔芬的结构 雷洛昔芬的结构
简介和背景
他莫昔芬和雷洛昔芬都是在结构上与雌性激素类似的处方药。他莫昔芬最初在1960年代被当作有可能的避孕药生产。在发现它在这方面没有效果之后,医生开始研究它对抗雌激素刺激的癌症的方法。97
98
在1970年代,它在晚期乳腺癌患者身上经过测试,并且被发现是有效的疗法。在1998年,它被批准为第一种针对乳腺癌高危女性的化学预防药剂。 98
99
他莫昔芬和雷洛昔芬被分类为选择性雌激素受体调节剂(SERMs) 因为它们能够阻止细胞对于雌激素作出反应。目前已知他莫昔芬会引起子宫癌和可能会堵塞血管的血块(血栓性栓塞)。正是因为这些有害的副作用,医生建议只有拥有着乳腺癌高风险的女性才应该使用这种药物来预防癌症99
100
。
科学研究
早期研究显示乳腺癌的肿瘤生成在接受他莫昔芬治疗的实验鼠中被抑制住了101
。在他莫昔芬有益的效果以外,它也能够提高子宫内膜和子宫癌的风险。这有可能是它在健康细胞内破坏DNA的能力导致的102
。他莫昔芬和雷洛昔芬都显示能够在高危女性中把侵入性乳腺癌的发病率减少50%。103
104
105
106
美国食物和药品管理局批准
他莫昔芬在1977年被FDA批准为乳腺癌的治疗方案。他莫昔芬随即又被批准为防止手术治疗乳腺癌的复发和在高位女性人群中预防乳腺癌98
。雷洛昔芬也被FDA批准来预防和对抗癌症以及骨质流失(骨质疏松)。107
104
癌症疫苗
癌症的预防是癌症研究者和临床医师最终的目标。达到这个目的的一种好办法是预防感染(病毒,细菌,和寄生虫)已知能够导致癌症的病原体。疫苗被研究出来并通过了批准来预防乙型肝炎病毒感染,一种肝癌的病因,以及人乳头瘤病毒,主要的宫颈癌和在男性女性中头颈部以及生殖泌尿道的一些癌症的起因。学习更多关于被批准的疫苗的信息:
宫颈癌疫苗
对抗HPV的疫苗的研究是与宫颈癌的战斗中重要的一步。
目前有三种被批准的预防HPV感染的疫苗, Gardasil®, Gardasil 9® 和 Cervarix®.
Gardasil® 是经过FDA批准的在9-26岁的年轻女性中预防HPV种类6,11,16,和18 感染的疫苗。在2009年十月十六号,FDA也通过了 Gardasil® 来在9-26岁的年轻男性中预防HPV种类6和11导致的尖锐湿疣。108 109 在2016年,CDC改变了他们对于11-12岁大的儿童的建议,允许他们只接种两次HPV疫苗而不再是三次。 在15-26岁接种的人群仍然需要接受三次疫苗接种。110
Cervarix® 也能够预防HPV 16和18的感染。Cervarix® 在2009年九月在美国被批准使用。111
重要的一点是,疫苗是预防性质的并且不能阻止已经存在的HPV感染或是宫颈非典型增生的恶化,并且不应该让女性停止去做年度检查,尤其因为并不是所有能够引起癌症的(肿瘤原性)的HPV种类都被疫苗所涵盖。111 112
观看视频来学习更多关于HPV疫苗的知识。观看与Dr. Ira Horowitz的完整采访。
因为最近在这个领域使人振奋的新发现,我们更加深入地介绍这种疗法并讨论其发展。
大部分的宫颈癌都被认为是被人乳头瘤病毒(HPV)所引起的。HPV拥有着百余种变种(亚类),但是只有一小部分与人类癌症有关联。HPV亚类16和18是最常与人类宫颈癌产生联系的变种。HPV的几种特征都让它成为疫苗研发的好目标。这种病毒结构简单,小型,并且拥有稳定的基因组。HPV疫苗研发和临床试验正在继续。
Gardasil®
策略
如上述,疫苗的目的是增强免疫系统对于特病原体的反应。原理是如果我们的免疫系统再次“见到” 某种蛋白,它可以对其做出剧烈的反应。在有病毒的场合下,免疫系统往往会对病毒表面的蛋白质作出反应。
在实验室里,研究人员可以制造出不会感染的类病毒颗粒(VLP),让它们既类似于有感染性的病毒又不包含病毒DNA且不能繁殖。这些VLPs包含病毒蛋白质并且能够在进入人体后引起一样的体液免疫反应。两种不同的VLP为基础的人乳头瘤病毒疫苗已经进入了后期研发和使用阶段。
The Agent
Gardasil®
第一种获得FDA批准的癌症预防疫苗就是Gardasil®. Gardasil® 的设计理念是预防四种不同亚类的HPV(6,11,16,和18)的感染。HPV种类6和11加起来导致了90%的尖锐湿疣病例,而16和18加起来引起了70%的宫颈癌病例。Gardasil® 包含了携带着这四种HPV病毒的表面蛋白的VLP。
Gardasil® 的生产来自于 Merck Pharmaceuticals。Agent在2008年的6月8日被FDA批准为给9-26岁的年轻女性种预防宫颈癌(和尖锐湿疣)的方法并且对于其他年龄段的人群以及与其他疫苗的组合治疗进行了效果测试。在2009年的10月16日,Gardasil® 被批准给9-26岁的男性使用。
数据
在成功的I和II期临床试验后,总共有12,167位女性,年龄在16-26岁之间,在巴西,哥伦比亚,丹麦,芬兰,冰岛,墨西哥,挪威,秘鲁,波兰,新加坡,瑞典,英国和美国的90个不同的研究中心登记参与了III期临床试验。在超过12,000名参与这种,6,082名女性接受了三次Gardasil接种而剩下的6,075得到了安慰剂。研究调查了HPV16或18引起的宫颈癌前兆或是非侵入性的癌症。
具体来说,参与者经过了中期(2)和晚期(3)宫颈上皮内瘤变(CIN)的检查,而3级CIN也被称为原位癌(CIS)。CIS是直接的浸润性鳞状细胞宫颈癌前兆。参与者也被检查了原位腺癌的产生(AIS),腺性宫颈癌的前兆之一。实验的结果显示 Gardasil® 在可能破坏了规程或是在实验中感染了病毒的女性中预防了100%与HPV16或18有关的高级癌症前兆和非入侵式癌症。疗法在2006年的夏天得到了FDA批准。113 114 115



Gardasil 9®
以Gardasil®的成功为基础,能够提供更多人乳头瘤病毒变种的保护的新的疫苗被研制出来了。
Gardasil 9® 包含了九种HPV种类, 其中四种在已经被批准的Gardasil® 里而五种并不被先前经过批准的 Gardasil® 所包含。额外的五种HPV种类时31,33,45,52,和58,并且会导致大约20%的宫颈癌。Gardasil 9® 会分为三次注射:最初剂量,最初剂量后两个月的第二次注射,和最初剂量后六个月的第三次注射。
在一项美国和海外执行的临床试验中,大约14,000名参与者(年龄在16-26岁的女性)被注射了Gardasil® 或是 Gardasil®9. Gardasil®9 被发现97% 有效地预防了由HPV 31, 33,45, 和58引起的疾病。它也能与Gardasil® 一样有效地预防HPV 6,11,16,和18引起的疾病。常见的副作用包括注射区域的疼痛,肿胀,发红,和头疼。
Gardasil 9® 被 Merck Pharmaceuticals 所生产。在2014年的12月10日,Gardasil 9® 被批准给9-26岁的女性使用。在2015年,疫苗可以注射给9-15岁的男性,而在2016年,两次注射的计划被批准给9-14岁的人群使用。116
更多关于Merck的 Gardasil®
在国家癌症研究所寻找与Gardasil®有关的临床试验
Cervarix®
第二种HPV疫苗, Cervarix®, 来自于 GlaxoSmithKline, 在2009年的十月被美国食品药品监督管理局(FDA)批准可以给年龄10-25岁的女性使用。117 疫苗的设计理念是预防HPV 16和18的感染,两种导致了70%宫颈癌的HPV亚类。除了两种VLP以外,疫苗也包含了化学物质(氢氧化铝和3-O-脱酰单磷酸类脂A(AS04))用来增强免疫系统对于病毒蛋白的反应。
一项III期的双盲,安慰剂对照的 Cervarix® 实验在多于1,100名北美和巴西的15-25岁的女性身上展开。接受Cervarix® 的参与者在六个月的期间内接受了三次接种,与Gardasil® 的接种方式类似。在之后的27的月内进行了复查。研究者发现了疫苗能够92%有效地预防新的感染并提供100%的长期HPV感染保护。这些结果也显示AS04能够帮助疫苗来激活比自然感染更加强烈的抗体反应。118
在2016年, Cervarix® 从美国市场撤出。119
肝癌 (乙型肝炎病毒)
长期的肝炎病毒感染是导致肝癌的一大风险诱因。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)都与肝癌有着联系。120 121 在全球范围内,乙型肝炎病毒的感染极为普遍,在2005年预计有2.4亿人感染。122
一种对抗乙型肝炎病毒的疫苗在1981年被批准,让它成为了第一种预防癌症的疫苗。123 现在,美国的新生儿在出生后不久就会接种乙型肝炎病毒的疫苗。成人也应该接受乙型肝炎病毒的疫苗。124 125 目前没有能够预防丙型肝炎病毒感染的疫苗。
癌症预防表格
| 分类 |
化学物质 |
| 药物 | 非甾体抗炎药, 他莫昔芬,雷洛昔芬 |
| 植物化学物质 | 花青素, 姜黄素, EGCG, 番茄红素, 植物雌激素, 碧萝芷, 白藜芦醇, 硒, 维他命 E |
| 受影响的生物过程 |
化学物质 |
| 血管生成 | 姜黄素, EGCG, 白藜芦醇 |
| 细胞凋亡 | 花青素, 姜黄素, EGCG, 番茄红素, 白藜芦醇, 硒 |
| 发炎 | 花青素, 碧萝芷, 非甾体抗炎药 |
| 转移 | 姜黄素, 非甾体抗炎药, 维他命 E, 白藜芦醇 |
| 氧化 (比如说 抗氧化物) |
花青素, 姜黄素, EGCG, 番茄红素, 植物雌激素, 碧萝芷 |
| 激增 | 花青素, 姜黄素, 非甾体抗炎药, EGCG, 硒, |
| 酶活动 | 非甾体抗炎药 |
| 基因活动 | 他莫昔芬,雷洛昔芬 |
- 1Littman AJ, Beresford SA, White E: The association of dietary fat and plant foods with endometrial cancer (United States). Cancer Causes Control 12 (8): 691-702, 2001 [PUBMED]
- 2McCann SE, Freudenheim JL, Marshall JR, et al.: Diet in the epidemiology of endometrial cancer in western New York (United States). Cancer Causes Control 11 (10): 965-74, 2000. [PUBMED]
- 3Howe GR, Benito E, Castelleto R, et al.: Dietary intake of fiber and decreased risk of cancers of the colon and rectum: evidence from the combined analysis of 13 case-control studies. J Natl Cancer Inst 84 (24): 1887-96, 1992. [PUBMED]
- 4Morse DE, Pendrys DG, Katz RV, et al.: Food group intake and the risk of oral epithelial dysplasia in a United States population. Cancer Causes Control 11 (8): 713-20, 2000. [PUBMED]
- 5Buiatti E, Palli D, Decarli A, et al.: A case-control study of gastric cancer and diet in Italy: II. Association with nutrients. Int J Cancer 45 (5): 896-901, 1990. [PUBMED]
- 6Neuhouser ML, Patterson RE, Thornquist MD, et al.: Fruits and vegetables are associated with lower lung cancer risk only in the placebo arm of the beta-carotene and retinol efficacy trial (CARET). Cancer Epidemiol Biomarkers Prev 12 (4): 350-8, 2003. [PUBMED]
- 7Fuchs CS, Giovannucci EL, Colditz GA, et al.: Dietary fiber and the risk of colorectal cancer and adenoma in women. N Engl J Med 340 (3): 169-76, 1999 [PUBMED]
- 8Michels KB, Edward Giovannucci, Joshipura KJ, et al.: Prospective study of fruit and vegetable consumption and incidence of colon and rectal cancers. J Natl Cancer Inst (2000) 92(21): 1740-52. [PUBMED]
- 9Jain MG, Rohan TE, Howe GR, et al.: A cohort study of nutritional factors and endometrial cancer. Eur J Epidemiol (2000) 16 (10): 899-905. [PUBMED]
- 10Friedenreich CM: Physical activity and cancer prevention: from observational to intervention research. Cancer Epidemiol Biomarkers Prev 10 (4): 287-301, 2001. [PUBMED]
- 11Schouten LJ, Goldbohm RA, van den Brandt PA: Anthropometry, physical activity, and endometrial cancer risk: results from the Netherlands Cohort Study. J Natl Cancer Inst 96 (21): 1635-8, 2004. [PUBMED]
- 12Vainio H, Weiderpass E. Fruit and Vegetables in Cancer Prevention. Nutrition and Cancer. (2006) 54(1):111-42 [PUBMED]
- 13Greenwald P, Anderson D, Nelson SA, Taylor PR. Clinical trials of vitamin and mineral supplements for cancer prevention. Am J Clin Nutr. (2007) 85(1):314S-317S. [PUBMED]
- 14Boffetta P, Pershagen G, Jöckel KH, et al.: Cigar and pipe smoking and lung cancer risk: a multicenter study from Europe. J Natl Cancer Inst 91 (8): 697-701, 1999 [PUBMED]
- 15Anthonisen NR, Skeans MA, Wise RA, et al.: The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 142 (4): 233-9, 2005. [PUBMED]
- 16Koh HK: The end of the "tobacco and cancer" century. J Natl Cancer Inst 91 (8): 660-1, 1999. [PUBMED]
- 17 a b Morimoto LM, White E, Chen Z, et al.: Obesity, body size, and risk of postmenopausal breast cancer: the Women's Health Initiative (United States). Cancer Causes Control 13 (8): 741-51, 2002. [PUBMED]
- 18Bagnardi V, Blangiardo M, La Vecchia C, et al.: Alcohol consumption and the risk of cancer: a meta-analysis. Alcohol Res Health 25 (4): 263-70, 2001 [PUBMED]
- 19Purdie DM, Green AC: Epidemiology of endometrial cancer. Best Pract Res Clin Obstet Gynaecol 15 (3): 341-54, 2001 [PUBMED]
- 20Bergström A, Pisani P, Tenet V, et al.: Overweight as an avoidable cause of cancer in Europe. Int J Cancer 91 (3): 421-30, 2001. [PUBMED]
- 21Preston DS, Stern RS: Nonmelanoma cancers of the skin. N Engl J Med 327 (23): 1649-62, 1992 [PUBMED]
- 22English DR, Armstrong BK, Kricker A, et al.: Case-control study of sun exposure and squamous cell carcinoma of the skin. Int J Cancer 77 (3): 347-53, 1998. [PUBMED]
- 23Czene K, Lichtenstein P, Hemminki K. Environmental and heritable causes of cancer among 9.6 million individuals in the Swedish Family-Cancer Database. Int J Cancer 2002;99:260266 [PUBMED]
- 24Lawrence H. Kushi, Tim Byers, Colleen Doyle, Elisa V. Bandera, Marji McCullough, Ted Gansler, Kimberly S. Andrews, Michael J. Thun and The American Cancer Society 2006 Nutrition and Physical Activity Guidelines Advisory Committee. CA Cancer J Clin (2006) 56; 254-281 [PUBMED]
- 25World Health Organization. Cancer Fact Sheet No. 297. February 2006. Accessed 2 June 2010. [http://www.who.int/mediacentre/factsheets/fs297/en/index.html]
- 26Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortaily from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. (2003) 348: 1625-38 [PUBMED]
- 27World Health Organization "Physical Activity" https://www.who.int/health-topics/physical-activity#tab=tab_1
- 28. (2018). The Physical Activity Guidelines for Americans. Jama, 320(19), 2020-2028. http://doi.org/10.1001/jama.2018.14854 (Original work published December 2018) [PUBMED]
- 29. (2017). Exercise and cancer: from "healthy" to "therapeutic"?. Cancer Immunology, Immunotherapy : Cii, 66(5), 667-671. http://doi.org/10.1007/s00262-017-1985-z (Original work published May 2017) [PUBMED]
- 30. (2018). Physical activity and cancer: an umbrella review of the literature including 22 major anatomical sites and 770 000 cancer cases. British Journal Of Sports Medicine, 52(13), 826-833. http://doi.org/10.1136/bjsports-2017-098391 (Original work published July 2018) [PUBMED]
- 31. (2014). The association between physical activity and bladder cancer: systematic review and meta-analysis. British Journal Of Cancer, 110(7), 1862-70. http://doi.org/10.1038/bjc.2014.77 (Original work published April 2014) [PUBMED]
- 32. (2019). Adult Physical Activity and Breast Cancer Risk in Women with a Family History of Breast Cancer. Cancer Epidemiology, Biomarkers & Prevention : A Publication Of The American Association For Cancer Research, Cosponsored By The American Society Of Preventive Oncology, 28(1), 51-58. http://doi.org/10.1158/1055-9965.EPI-18-0674 (Original work published December 2019) [PUBMED]
- 33. (2018). Effects of physical activity on colorectal cancer risk among family history and body mass index subgroups: a systematic review and meta-analysis. Bmc Cancer, 18(1), 71. http://doi.org/10.1186/s12885-017-3970-5 (Original work published December 2018) [PUBMED]
- 34. (2007). Physical activity and endometrial cancer risk, a systematic review of current evidence. Cancer Epidemiology, Biomarkers & Prevention : A Publication Of The American Association For Cancer Research, Cosponsored By The American Society Of Preventive Oncology, 16(4), 639-48. (Original work published April 2007) [PUBMED]
- 35. (2014). Physical activity and risks of esophageal and gastric cancers: a meta-analysis. Plos One, 9(2), e88082. http://doi.org/10.1371/journal.pone.0088082 (Original work published December 2014) [PUBMED]
- 36. (2013). The association between physical activity and renal cancer: systematic review and meta-analysis. British Journal Of Cancer, 108(4), 798-811. http://doi.org/10.1038/bjc.2013.37 (Original work published March 2013) [PUBMED]
- 37. (2007). Exercise and biomarkers for cancer prevention studies. The Journal Of Nutrition, 137(1 Suppl), 161S-169S. http://doi.org/10.1093/jn/137.1.161S (Original work published December 2007) [PUBMED]
- 38. (2007). Exercise and biomarkers for cancer prevention studies. The Journal Of Nutrition, 137(1 Suppl), 161S-169S. http://doi.org/10.1093/jn/137.1.161S (Original work published December 2007) [PUBMED]
- 39. (2007). Exercise and biomarkers for cancer prevention studies. The Journal Of Nutrition, 137(1 Suppl), 161S-169S. http://doi.org/10.1093/jn/137.1.161S (Original work published December 2007) [PUBMED]
- 40. (2019). Association of type and intensity of physical activity with plasma biomarkers of inflammation and insulin response. International Journal Of Cancer, 145(2), 360-369. http://doi.org/10.1002/ijc.32111 (Original work published December 2019) [PUBMED]
- 41. (2013). Effects and potential mechanisms of exercise training on cancer progression: a translational perspective. Brain, Behavior, And Immunity, 30 Suppl, S75-87. http://doi.org/10.1016/j.bbi.2012.05.001 (Original work published March 2013) [PUBMED]
- 42. (2013). Effects and potential mechanisms of exercise training on cancer progression: a translational perspective. Brain, Behavior, And Immunity, 30 Suppl, S75-87. http://doi.org/10.1016/j.bbi.2012.05.001 (Original work published March 2013) [PUBMED]
- 43. (2019). Association of type and intensity of physical activity with plasma biomarkers of inflammation and insulin response. International Journal Of Cancer, 145(2), 360-369. http://doi.org/10.1002/ijc.32111 (Original work published December 2019) [PUBMED]
- 44. (2017). Exercise and cancer: from "healthy" to "therapeutic"?. Cancer Immunology, Immunotherapy : Cii, 66(5), 667-671. http://doi.org/10.1007/s00262-017-1985-z (Original work published May 2017) [PUBMED]
- 45. (2020). Anticancer effect of physical activity is mediated by modulation of extracellular microRNA in blood. Oncotarget, 11(22), 2106-2119. http://doi.org/10.18632/oncotarget.27609 (Original work published June 2020) [PUBMED]
- 46. (2020). Exercise shapes redox signaling in cancer. Redox Biology, 35, 101439. http://doi.org/10.1016/j.redox.2020.101439 (Original work published December 2020) [PUBMED]
- 47. (2013). Effects and potential mechanisms of exercise training on cancer progression: a translational perspective. Brain, Behavior, And Immunity, 30 Suppl, S75-87. http://doi.org/10.1016/j.bbi.2012.05.001 (Original work published March 2013) [PUBMED]
- 48. (2013). Racial, Ethnic, and Gender Differences in Physical Activity. Journal Of Human Capital, 7(4), 378-410. (Original work published December 2013) [PUBMED]
- 49. (2014). Racial differences in physical activity among breast cancer survivors: implications for breast cancer care. Cancer, 120(14), 2174-82. http://doi.org/10.1002/cncr.28630 (Original work published July 2014) [PUBMED]
- 50Valcheva-Kuzmanova S.V., Belcheva A. Colon-available raspberry polyphenols exhibit anti-cancer effects on in vitro models of colon cancer. Journal of Carcinogenesis (2007) Apr 18; 6: 4 [PUBMED]
- 51Lin Y.G., Kunnumakkara A., et al. Curcumin Inhibits Tumor Growth and Angiogenesis in Ovarian Carcinoma by targeting the Nuclear Factor-ºB Pathway. Clin Cancer Res 2007 13: 3423-3430 [PUBMED]
- 52Yanase S, Yasuda K, Ishii N: Adaptive responses to oxidative damage in three mutants of Caenorhabditis elegans (age-1, mev-1 and daf-16) that affect life span. Mech Ageing Dev. (2002) 123:1579-1587 [PUBMED]
- 53Missirlis F, Phillips JP, Jackle H: Cooperative action of antioxidant defense systems in Drosophila. Curr Biol. (2001) 11:1272-1277 [PUBMED]
- 54Halliwell B and Gutteridge MC. Free Radicals in Biology and Medicine. Fifth Edition (2015) Oxford University Press. ISBN 9780198717485. [ Publisher]
- 55 a b Halliwell, Barry. (May 3, 2005) Free radicals and other reactive species in disease. In: Encyclopedia of Life Sciences. John Wiley & Sons, Ltd: Chichester http://www.els.net/ [doi:10.1038/npg.els.0006101] [http://www.els.net/ [doi:10.1038/npg.els.0006101]]
- 56Wang, H., X. Liu, M. Long, Y. Huang, L. Zhang, R. Zhang, Y. Zheng, X. Liao, Y. Wang, Q. Liao, W. Li, Z. Tang, Q. Tong, X. Wang, F. Fang, M. R. De La Vega, Q. Ouyang, D. D. Zhang, S. Yu, and H. Zheng. "NRF2 Activation by Antioxidant Antidiabetic Agents Accelerates Tumor Metastasis." Science Translational Medicine 8.334 (2016). [http://www.ncbi.nlm.nih.gov/pubmed/?term=NRF2+activation+by+antioxidant+antidiabetic+agents+accelerates+tumor+metastasis] [PUBMED]
- 57Ramsey MR, Sharpless NE: ROS as a tumour suppressor? Nat Cell Biol. (2006) 8: 1213-1215 [PUBMED]
- 58Irminger-Finger I. Science of cancer and aging. J Clin Oncol. 2007 May 10;25(14):1844-51 [PUBMED]
- 59Villarreal G, Zagorski J, Wahl Sm (January 29, 2003). Inflammation: Acute. In: ENCYCLOPEDIA OF LIFE SCIENCES. John Wiley & Sons, Ltd: Chichester [http://www.els.net/ [doi:10.1038/npg.els.0006101]]
- 60Fox JG, Wang TC. Inflammation, atrophy and gastric cancer. J Clin Invest. (2007) 117: 60-9 [PUBMED]
- 61Dobrovolskaia MA, Kozlov SV. Inflammation and cancer: when NF-ºB amalgamates the perilous partnership. Current Cancer Drug Targets. (2005) 5:325-44 [PUBMED]
- 62de Visser KE, Eichten A, Coussens LM. Paradoxical roles of the immune system during cancer development. Nature Reviews. Cancer. (2006) 6: 24-37. [PUBMED]
- 63MacDonald N. Cancer cachexia and targeting chronic inflammation: a unified approach to cancer treatment and palliative/supportive care. J Support Oncol. (2007) 5(4): 157-62 [PUBMED]
- 64Villarreal G, Zagorski J, Wahl Sm (January 29, 2003). Inflammation: Acute. In: ENCYCLOPEDIA OF LIFE SCIENCES. John Wiley & Sons, Ltd: Chichester [http://www.els.net/ [doi:10.1038/npg.els.0006101]]
- 65 a b Baron JA, Cole BF, Sandler RS, et al. A randomized trial of aspirin to prevent colorectal adenomas. N Engl J Med (2003) 348: 891-9. [PUBMED]
- 66 a b Campbell CL, Smyth S, Nontalescot G, Steinhubl SR. Aspirin dose for the prevention of cardiovascular disease: a systematic review. JAMA. (2007) 297(18): 2018-24 [PUBMED]
- 67Chan AT. Aspirin, non-steroidal anti-inflammatory drugs, and colorectal neoplasia: future challenges in chemoprevention. Cancer Causes Control (2003) 14: 413-8 [PUBMED]
- 68Bertagnolli MM. Chemoprevention of colorectal cancer with cyclooxygenase-2 inhibitors: two steps forward, one step back. Lancet Oncol. (2007) May;8(5):439-43. [PUBMED]
- 69Sandler RS, Halabi S, Baron JA, et al. A randomized trial of aspirin to prevent colorectal adenomas in patients with previous colorectal cancer. N Engl J Med (2003) 348: 883-90. [PUBMED]
- 70Bertagnolli MM, Eagle CJ, Zauber AG, et al. Celecoxib for the prevention of sporadic colorectal adenomas. N Engl J Med (2006) 355: 873-84 [PUBMED]
- 71Arber N, Eagle CJ, Spicak J, et al. Celecoxib for the prevention of colorectal adenomatous polyps. N Engl J Med (2006) 355: 885-95 [PUBMED]
- 72Leibowitz B, Qiu W, Buchanan ME, Zou F, Vernon P, Moyer MP, Yin XM, Schoen RE, Yu J, Zhang. BID mediates selective killing of APC-deficient cells in intestinal tumor suppression by nonsteroidal antiinflammatory drugs. Proc Natl Acad Sci U S A. 2014 Nov 18;111(46):16520-5. [PUBMED]
- 73Chan AT, Ogino S, Fuchs CS. Aspirin and the risk of colorectal cancer in relation to the expression of COX-2. N Engl J Med. (2007) 356(21): 2131-42. [PUBMED]
- 74Couzin J. Drug Safety. FDA panel urges caution on many anti-inflammatory drugs. Science. (2005) 307(5713): 1183-5 [PUBMED]
- 75Markowitz SD. Aspirin and colon cancer--targeting prevention? N Engl J Med. (2007) 356(21): 2195-8. [PUBMED]
- 76Omer ZB, Ananthakrishnan AN, Nattinger KJ, Cole EB, Lin JJ, Kong CY, Hur C. Aspirin Protects Against Barrett's Esophagus in a Multivariate Logistic Regression Analysis. Clin Gastroenterol Hepatol. 2012 Jul;10(7):722-7. Epub 2012 Mar 15. [PUBMED]
- 77Baron JA. Aspirin and cancer: trials and observational studies. J Natl Cancer Inst. 2012 Aug 22;104(16):1199-200. [PUBMED]
- 78Bosetti C, Gallus S, La Vecchia C. Aspirin and cancer risk: a summary review to 2007. Recent Results Cancer Res. 2009;181:231-51. [PUBMED]
- 79Cooper K, Squires H, Carroll C, Papaioannou D, Booth A, Logan RF, Maguire C, Hind D, Tappenden P. Chemoprevention of colorectal cancer: systematic review and economic evaluation. Health Technol Assess. 2010 Jun;14(32):1-206. [PUBMED]
- 80Chan AT, Giovannucci EL, Meyerhardt JA, et al. Aspirin dose and duration of use and risk of colorectal cancer in men. Gastroenterology 2008;134:21¿28.
- 81Chan AT, Giovannucci EL, Meyerhardt JA, et al. Long-term use of aspirin and nonsteroidal anti-inflammatory drugs and risk of colorectal cancer. JAMA 2005;294:914¿923.
- 82Noreen F, Röösli M, Gaj P, Pietrzak J, Weis S, Urfer P, Regula J, Schär P, Truninger K.Modulation of age- and cancer-associated DNA methylation change in the healthy colon by aspirin and lifestyle. J Natl Cancer Inst. 2014 Jun 28;106(7). [PUBMED]
- 83Cook NR, Lee IM, Gaziano JM, et al. Low-dose aspirin in the primary prevention of cancer: the Women¿s Health Study: a randomized controlled trial. JAMA 2005;294:47¿55.
- 84Gann PH, Manson JE, Glynn RJ, et al. Low-dose aspirin and incidence of colorectal tumors in a randomized trial. J Natl Cancer Inst 1993;85:1220¿1224.
- 85Chan AT, Giovannucci EL. Primary prevention of colorectal cancer. Gastroenterology. 2010 Jun;138(6):2029-2043.e10. [PUBMED]
- 86Brasky TM, Velicer CM, Kristal AR, Peters U, Potter JD, White E. Non-Steroidal Anti-Inflammatory Drugs and Prostate Cancer Risk in the VITamins And Lifestyle (VITAL) Cohort. Cancer Epidemiol Biomarkers Prev. 2010 Oct 8. [PUBMED]
- 87Fowke JH, Motley SS, Smith JA Jr, Cookson MS, Concepcion R, Chang SS, Byerly S. Association of nonsteroidal anti-inflammatory drugs, prostate specific antigen and prostate volume. J Urol. 2009 May;181(5):2064-70 [PUBMED]
- 88 a b c Takkouche B, Regueira-Méndez C, Etminan M.Breast cancer and use of nonsteroidal anti-inflammatory drugs: a meta-analysis. J Natl Cancer Inst. 2008 Oct 15;100(20):1439-47. [PUBMED]
- 89Zhao YS, Zhu S, Li XW, Wang F, Hu FL, Li DD, Zhang WC, Li X. Association between NSAIDs use and breast cancer risk: a systematic review and meta-analysis. Breast Cancer Res Treat. 2009 Sep;117(1):141-50. [PUBMED]
- 90Bhattacharyya M, Girish GV, Ghosh R, Chakraborty S, Sinha AK. Acetyl salicyclic acid (aspirin) improves synthesis of maspin and lowers incidence of metastasis in breast cancer patients. Cancer Sci. 2010 Oct;101(10):2105-9. [PUBMED]
- 91Trabert B, Poole EM, White E, Visvanathan K, Adami HO, Anderson GL, Brasky TM, Brinton LA, Fortner RT, Gaudet M, Hartge P, Hoffman-Bolton J, Jones M, Lacey JV Jr, Larsson SC, Mackenzie GG, Schouten LJ, Sandler DP, O'Brien K, Patel AV, Peters U, Prizment A, Robien K, Setiawan WV, Swerdlow A, van den Brandt PA, Weiderpass E, Wilkens LR, Wolk A, Wentzensen N, Tworoger SS; Ovarian Cancer Cohort Consortium (OC). Analgesic Use and Ovarian Cancer Risk: An Analysis in the Ovarian Cancer Cohort Consortium. J Natl Cancer Inst. 2018 May 31. doi: 10.1093/jnci/djy100. PubMed [PUBMED]
- 92Merritt MA, Rice MS, Barnard ME, Hankinson SE, Matulonis UA, Poole EM, Tworoger SS. Pre-diagnosis and post-diagnosis use of common analgesics and ovarian cancer prognosis (NHS/NHSII): a cohort study. Lancet Oncol. 2018 Jul 17. pii: S1470-2045(18)30373-5. doi: 10.1016/S1470-2045(18)30373-5. PubMed [PUBMED]
- 93. (2020). Effect of aspirin on cancer incidence and mortality in older adults. Journal Of The National Cancer Institute. http://doi.org/10.1093/jnci/djaa114 (Original work published August 2020) [PUBMED]
- 94US Food and Drug Adminstration website. Accessed 6/20/2016. [http://www.fda.gov/]
- 95Routine Aspirin or Nonsteroidal Anti-inflammatory Drugs for the Primary Prevention of Colorectal Cancer: U.S. Preventive Services Task Force Recommendation Statement. Annals of Internal Medicine. 2007 Mar;146(5):361-364. [PubMed]
- 96 Archived Final Recommendation Statement Aspirin/NSAIDs for Prevention of Colorectal Cancer: Preventive Medication Originally published on: December 30, 2013 Accessedd 1-7-2020 [USPS Archived Final Recommendation Statement on Aspirin/NSAIDS for the Prevention of Colorectal Cancer.]
- 97Jordan VC . Tamoxifen: a most unlikely pioneering medicine. Nat Rev Drug Discov. (2003) 2: 205-13 [PUBMED]
- 98 a b c Wozniak K, Kolacinska A, Blasinska-Morawiec M, Morawiec-Bajda A, Morawiec Z, Zadrozny M, Blasiak J. The DNA-damaging potential of tamoxifen in breast cancer and normal cells. Arch Toxicol. (2007) 81(7): 519-27 [PUBMED]
- 99 a b Jordan VC. SERMs: meeting the promise of multifunctional medicines. J Natl Cancer Inst. (2007) 99(5): 350-6. [PUBMED]
- 100Hu H, Jiang C, Ip C, Rustum YM, Lu J. Methylseleninic acid potentiates apoptosis induced by chemotherapeutic drugs in androgen-independent prostate cancer cells. Clinical Cancer Research (2005). 11: 2379-2388. [PUBMED]
- 101Jordan, V. C., Allen, K. E. & Dix, C. J. Pharmacology of tamoxifen in laboratory animals. Cancer Treat. Rep. (1980) 64: 745-759. [PUBMED]
- 102Poirier MC, Schild LJ. The genotoxicity of tamoxifen: extent and consequences. Mutagenesis. (2003) 18: 395399 [PUBMED]
- 103Cuzick J, Forbes J, Edwards R, et al. First results from the International Breast Cancer Intervention Study (IBIS-I): a randomized prevention trial. Lancet. (2002) 360:81724. [PUBMED]
- 104 a b Richardson H, Johnston D, Pater J, Goss P. The National Cancer Institute of Canada Clinical Trials Group MAP.3 trial: an international breast cancer prevention trial. Curr Oncol. (2007) 14(3): 89-96 [PUBMED]
- 105Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study. J Natl CancerInst (1998) 90: 1371-88 [PUBMED]
- 106Vogel VG, Costantino JP, Wickerham DL, et al. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomesthe NSABP study of tamoxifen and raloxifene (STAR) P-2 trial. JAMA. (2006) 295: 272741. [PUBMED]
- 107PETER H. RHEINSTEIN, M.D., J.D., M.S., U.S., Food and Drug Administration, Rockville, Maryland BARDIA AKBARI, PHARM.D., Robert Wood Johnson Medical School, New Brunswick, New Jersey Am Fam Physician. 1998 Jun 1;57(11):2865-2868. [Significant Drug FDA Approvals in 1997]
- 108Markowitz LE, Dunne EF, Saraiya M, Lawson HW, Chesson H, Unger ER; Centers for Disease Control and Prevention (CDC); Advisory Committee on Immunization Practices (ACIP).Quadrivalent Human Papillomavirus Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2007 Mar 23;56(RR-2):1-24. [PUBMED]
- 109U.S. Food and Drug Administration. News Release: FDA Approves New Indication for Gardasil to Prevent Genital Warts in Men and Boys. October 16, 2009. [http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm187003.htm]
- 110Centers for Disease Control and Prevention Newsroom. Accessed 11/1/2016. [http://www.cdc.gov/media/releases/2016/p1020-hpv-shots.html]
- 111 a b Food and Drug and Administration Vaccines, Blood, & Biologics Accessed January 8, 2020 [FDA Website]
- 112Gardasil® Website Registered by Merck & Co., Inc. Site accessed January 8, 2020 [ Gardasil Website]
- 113Lowndes CM. "Vaccines for cervical cancer." Epidemiology and Infection. (2006) 134: 1-12. [PUBMED]
- 114Schmiedeskamp, MR and DR Kockler. "Human Papillomavirus vaccines." 2006, The Annals of Pharmacotherapy 40(7):1344-52 [PUBMED]
- 115Food and Drug and Administration Vaccines, Blood, & Biologics Accessed October 21st, 2009 [FDA Cervarix® Website]
- 116FDA website https://www.fda.gov/biologicsbloodvaccines/vaccines/approvedproducts/ucm426445.htm Accessed 10-7-2017
- 117US Food and Drug Administration. FDA Approves raloxifene to prevent osteoporosis. U.S. Department of Health and Human Services. Dec 10, 1997. [http://www.fda.gov/bbs/topics/ANSWERS/ANS00838.html]
- 118Harper DM, et al. "Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomized controlled trial." The Lancet (2004) Nov 13; 364:1757-65. [PUBMED]
- 119 Mulcahy N. GSK’s HPV Vaccine, Cervarix, No Longer Available in US. Medscape. October 24, 2016 [LINK]
- 120El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012 May;142(6):1264-1273.e1. [PUBMED]
- 121Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol. 2006 Oct;45(4):529-38. Epub 2006 Jun 23. [PUBMED]
- 122Vaccine. 2012 Mar 9;30(12):2212-9. Epub 2012 Jan 24. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity. Vaccine. 2012 Mar 9;30(12):2212-9. Epub 2012 Jan 24. [PUBMED]
- 123Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. Atkinson W, Wolfe S, Hamborsky J, eds. 12th ed. Washington DC: Public Health Foundation, 2011. http://www.cdc.gov/vaccines/pubs/pinkbook/downloads/hepb.pdf Accessed July 20, 2011. [http://www.cdc.gov/vaccines/pubs/pinkbook/downloads/hepb.pdf]
- 124Mast EE, Margolis HS, Fiore AE, Brink EW, Goldstein ST, Wang SA, Moyer LA, Bell BP, Alter MJ; Advisory Committee on Immunization Practices (ACIP). A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 1: immunization of infants, children, and adolescents. MMWR Recomm Rep. 2005 Dec 23;54(RR-16):1-31. [PUBMED]
- 125Mast EE, Weinbaum CM, Fiore AE, Alter MJ, Bell BP, Finelli L, Rodewald LE, Douglas JM Jr, Janssen RS, Ward JW; Advisory Committee on Immunization Practices (ACIP) Centers for Disease Control and Prevention (CDC). A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part II: immunization of adults. MMWR Recomm Rep. 2006 Dec 8;55(RR-16):1-33; quiz CE1-4. [PUBMED]